Les tumeurs mammaires chez le chat correspondent à des proliférations cellulaires anormales et incontrôlées qui prennent naissance au sein du tissu épithélial et/ou mésenchymateux des glandes mammaires. Ces tumeurs font partie des cancers les plus fréquents chez le chat, représentant une préoccupation majeure en médecine vétérinaire.
Juillet 2025
Qu’est-ce qu’une tumeur mammaire chez la chatte?
Sur le plan épidémiologique, elles constituent le troisième type de néoplasie le plus fréquemment diagnostiqué chez le chat, se classant après les néoplasies hématopoïétiques, tels les lymphomes, et les tumeurs cutanées. Les données d’incidence varient de manière substantielle dans la littérature scientifique, avec des estimations allant de 13 à 104 cas pour 100 000 chats par an, une variabilité qui reflète les disparités dans les méthodologies de diagnostic, les pratiques cliniques et les contextes démographiques des populations étudiées. Bien que rares, les mâles peuvent aussi développer des tumeurs mammaires, en particulier lorsqu’ils sont exposés à des hormones, même si le risque de tumeurs mammaires chat reste beaucoup plus faible que chez les femelles.

Le point fondamental qui conditionne l’intégralité de la prise en charge de cette affection est la nature intrinsèquement agressive de ces tumeurs dans l’espèce féline. En effet, la quasi-totalité des tumeurs mammaires chez la chatte, soit 80 à 90 %, sont de nature maligne. Il s’agit dans la grande majorité des cas de carcinomes à haut potentiel métastatique. Cette proportion de malignité est drastiquement supérieure à celle observée chez la chienne, où elle avoisine les 50 %, ce qui souligne un comportement biologique fondamentalement différent et plus préoccupant. Cette prévalence écrasante de malignité impose une démarche clinique radicalement différente de celle adoptée pour l’espèce canine. Toute temporisation ou approche attentiste, parfois discutable chez la chienne, devient indéfendable chez la chatte, où chaque nodule palpable doit être considéré comme malin jusqu’à preuve du contraire, exigeant une investigation diagnostique immédiate et agressive.
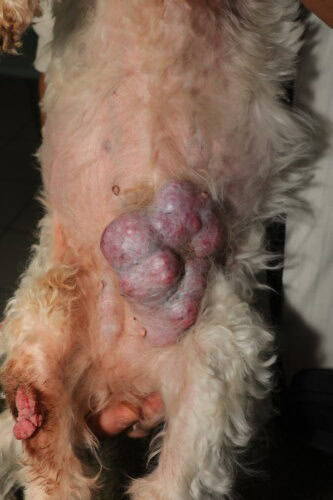
Sévère tumeur mammaire chez une chienne
Plusieurs facteurs de risque ont été clairement identifiés. Le plus déterminant est l’exposition aux hormones sexuelles endogènes, principalement les œstrogènes et la progestérone. Il est donc essentiel d’évaluer les risques liés à l’âge, à la stérilisation et à l’exposition hormonale afin de mettre en place une prévention efficace. En conséquence, la stérilisation chirurgicale précoce (ovariohystérectomie) constitue la mesure de prévention la plus efficace. Une intervention réalisée avant l’âge de six mois, soit avant les premières chaleurs, réduit le risque de développer une tumeur mammaire de plus de 90 %. L’effet protecteur diminue progressivement avec l’âge auquel la stérilisation est effectuée. Par ailleurs, l’administration de progestatifs exogènes, autrefois utilisés pour la contraception, est un facteur de risque majeur, formellement contre-indiqué. L’âge est également un facteur prépondérant ; la maladie affecte principalement les chattes d’âge moyen à avancé, avec un âge médian au diagnostic se situant entre 10 et 11 ans. Les chattes atteintes de néoplasmes malins sont d’ailleurs significativement plus âgées que celles présentant des lésions bénignes ou non néoplasiques. Enfin, une prédisposition raciale est suspectée, notamment chez les chats de race Siamois, qui pourraient développer des tumeurs à un âge plus précoce. La forte similitude entre le cancer du sein humain et les tumeurs mammaires félines, en termes d’âge d’apparition, de comportement biologique et de caractéristiques moléculaires, positionne le chat comme un modèle spontané d’étude précieux pour la recherche comparative en oncologie, dans une approche “One Health” bénéfique à la fois pour la santé humaine et animale.
Symptômes d’une tumeur mammaire
La présentation clinique des tumeurs mammaires félines est dominée par des signes locaux, bien que des manifestations systémiques puissent apparaître à un stade avancé de la maladie. Il existe différentes formes de tumeurs mammaires chez le chat, avec des présentations cliniques variées, allant de nodules isolés à des masses diffuses. Le symptôme le plus courant et le plus précoce est la découverte, souvent fortuite par le propriétaire ou lors d’un examen par le vétérinaire, d’une ou plusieurs masses, grosseurs ou nodules palpables au niveau du tissu d’une ou plusieurs mamelles. La détection d’une tumeur mammaire peut se faire lors de la palpation ou de l’examen clinique vétérinaire, soulignant l’importance d’un suivi régulier.
Ces masses ou grosseurs peuvent présenter des caractéristiques variables. Leur taille peut aller de quelques millimètres à plusieurs centimètres de diamètre. Elles sont généralement de consistance ferme et peuvent être soit mobiles sous la peau, soit, dans les cas plus avancés, adhérentes aux plans profonds (paroi thoracique ou abdominale), ce qui constitue un signe d’invasion locale. Les signes cliniques locaux qui doivent alerter sur une agressivité particulière de la tumeur incluent l’ulcération de la peau sus-jacente, une inflammation locale avec érythème et œdème, et une éventuelle douleur à la palpation. L’ulcération est un facteur pronostique négatif bien établi. Les tumeurs peuvent se développer sur n’importe laquelle des huit glandes mammaires, réparties en deux chaînes (une droite et une gauche), avec une tendance à une localisation légèrement plus fréquente sur les glandes abdominales caudales.
En raison du fort potentiel métastatique des carcinomes mammaires félins, des symptômes systémiques peuvent survenir. La dissémination se produit d’abord par voie lymphatique vers les ganglions lymphatiques régionaux (axillaires pour les mamelles thoraciques, inguinaux pour les mamelles abdominales), puis par voie hématogène vers des organes distants. Les sites métastatiques les plus fréquents sont les poumons et la plèvre, suivis par le foie, les glandes surrénales, les reins, les os et parfois les plèvres. Les cellules cancéreuses issues d’une tumeur mammaire peuvent donc atteindre différents organes comme les poumons, le foie, les os ou les plèvres. La présence de symptômes généraux comme une perte de poids progressive (cachexie cancéreuse), une léthargie, une perte d’appétit ou un état général dégradé chez une chatte présentant une masse mammaire ne doit pas être interprétée comme un simple signe de maladie. Ces manifestations sont de puissants indicateurs d’une probable maladie métastatique (Stade IV), ce qui modifie radicalement les objectifs du traitement, passant d’une intention curative à une approche palliative. Cette reconnaissance précoce évite d’engager l’animal dans des procédures chirurgicales lourdes et potentiellement futiles. Des signes plus spécifiques peuvent orienter vers une localisation métastatique particulière : une dyspnée, une toux ou une respiration rapide peuvent signaler une atteinte des poumons ou la présence d’un épanchement pleural malin.
Une forme clinique particulière, bien que rare, est le carcinome inflammatoire. Il se manifeste non pas par un nodule bien délimité, mais par une inflammation diffuse, chaude, douloureuse et œdémateuse de l’ensemble d’une chaîne mammaire, pouvant être confondue avec une mastite. Son pronostic est extrêmement sombre.
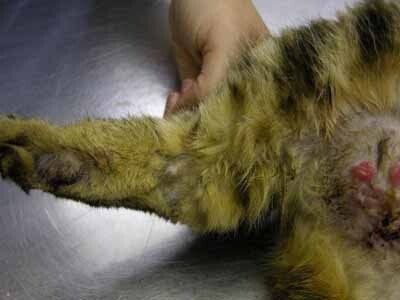
Carcinomatose mammaire (Crédit Christian Collinot)
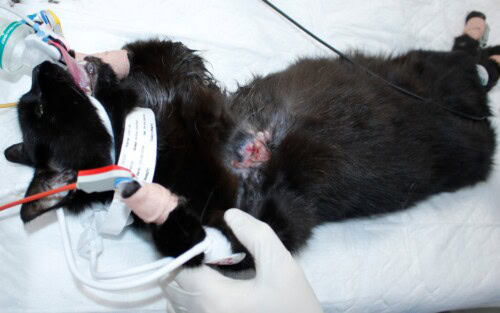
Tumeur mammaire ulcérée chez une chatte (Crédit Laurent Findji)
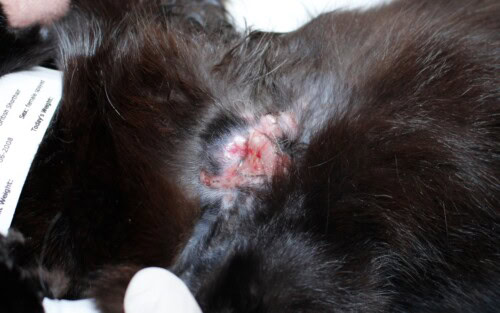
Vue rapprochée
Diagnostic d’une tumeur des glandes mammaires chez la chatte
L’établissement d’un diagnostic précis et d’un bilan d’extension complet est une étape fondamentale qui conditionne la stratégie thérapeutique et la formulation du pronostic pour une chatte atteinte d’une tumeur mammaire. La démarche diagnostique est un processus multi-étapes, allant de l’examen clinique à l’analyse histopathologique et à l’imagerie avancée.
La première étape consiste en un examen clinique rigoureux. Après avoir recueilli une anamnèse détaillée (âge, statut de stérilisation, antécédents de traitements hormonaux), le vétérinaire procède à une palpation méthodique des deux chaînes mammaires. Cette palpation vise à caractériser chaque nodule : nombre, localisation précise, taille (qui doit être mesurée avec un pied à coulisse pour plus de précision), consistance, et mobilité par rapport à la peau et aux plans profonds. Une attention toute particulière est portée à la palpation des ganglions lymphatiques régionaux drainants : les ganglions axillaires pour les deux paires de mamelles thoraciques et les ganglions inguinaux superficiels pour les deux paires de mamelles abdominales. Toute augmentation de taille ou modification de consistance de ces ganglions est suspecte d’une métastase.
La confirmation de la nature de la masse passe par des prélèvements cytologiques ou histologiques. La cytoponction à l’aiguille fine est un examen de première intention, rapide et peu invasif. Elle permet souvent de différencier une lésion inflammatoire d’un processus néoplasique et peut fortement suggérer la malignité en montrant des atypies cellulaires. Cependant, son utilité est limitée : elle ne permet pas d’établir un grade histologique ni de distinguer un carcinome in situ d’un carcinome invasif. Le “gold standard” pour le diagnostic définitif est donc la biopsie (incisionnelle pour les très grosses masses, mais préférentiellement excisionnelle) avec analyse histopathologique. Cet examen est indispensable car il fournit des informations cruciales :
-
Confirmation du diagnostic de carcinome.
-
Détermination du type histologique. Bien que le système de grading histologique d’Elston & Ellis, développé pour le cancer du sein humain, soit souvent mentionné, des études ont démontré sa faible valeur pronostique pour le carcinome mammaire félin. En raison de la nature très proliférative de ces tumeurs, des systèmes modifiés, notamment le ‘Mitotic-Modified Elston and Ellis’ (MMEE), ont été développés et validés. Ces systèmes, qui ajustent les seuils du compte mitotique, offrent une stratification pronostique nettement supérieure et devraient être considérés comme la norme actuelle pour l’évaluation histologique.
-
Établissement du grade histologique (de I à III) selon le système d’Elston et Ellis modifié pour le chat. Le grade, qui évalue le degré de différenciation tumorale, est l’un des facteurs pronostiques les plus puissants.
-
Détection de l’invasion lymphovasculaire, un critère histologique majeur indiquant un risque très élevé de dissémination métastatique.
Parallèlement, un bilan d’extension (stadification ou staging) doit être réalisé avant toute intervention chirurgicale majeure. Son but est de rechercher la présence de métastases. Il comprend au minimum des radiographies thoraciques en trois incidences (latérale droite, latérale gauche et ventro-dorsale) pour visualiser les poumons, site métastatique le plus fréquent. Le scanner thoracique offre une sensibilité supérieure pour la détection de petits nodules. Une échographie abdominale est également recommandée pour évaluer les ganglions lymphatiques intra-abdominaux et les autres organes cibles comme le foie.
L’ensemble de ces informations permet de classer la maladie selon le système de stadification TNM (Tumeur, Nodule/Ganglion, Métastase), qui est un outil essentiel pour la décision thérapeutique et la communication entre confrères. A noter que le système de stadification clinique TNM de l’OMS est la base historique, mais sa faible granularité, surtout pour les tumeurs de stade III, a conduit à des propositions de systèmes plus raffinés. Des études récentes ont évalué un système adapté de l’AJCC humain, qui subdivise le stade III en IIIA, IIIB et IIIC en fonction de la taille tumorale, de l’atteinte cutanée (T4) et du statut ganglionnaire (N1). Ce nouveau système offre une meilleure discrimination pronostique, identifiant les cas avec atteinte ganglionnaire (IIIC) comme ayant le pronostic le plus sombre, et représente l’approche la plus actuelle de la stadification.
Tableau 1 : Stadification Clinique des Carcinomes Mammaires Félins (Système OMS Modifié et Nouvelle Proposition)
|
Catégorie |
Définition |
|
T (Tumeur Primaire) |
|
|
T1 |
Tumeur < 2 cm de diamètre |
|
T2 |
Tumeur de 2 à 3 cm de diamètre |
|
T3 |
Tumeur > 3 cm de diamètre |
|
T4 |
Tumeur de toute taille avec invasion de la paroi ou peau (ulcération/inflammation) |
|
N (Ganglions Régionaux) |
|
|
N0 |
Absence de métastase ganglionnaire |
|
N1 |
Présence de métastase ganglionnaire |
|
M (Métastase à Distance) |
|
|
M0 |
Absence de métastase à distance |
|
M1 |
Présence de métastase à distance |
|
Stades Cliniques |
Combinaison TNM |
|
Stade I |
T1 N0 M0 |
|
Stade II |
T2 N0 M0 |
|
Stade III |
T3 N0 M0 ou T1-2 N1 M0 |
|
Stade IV |
T4 N0 M0 ou Tout T N1 M0 ou Tout T Tout N M1 |
|
Proposition de Nouveau Staging (NS) |
|
|
Stade IIIA |
T3 N0 M0 |
|
Stade IIIB |
T4 N0 M0 |
|
Stade IIIC |
Tout T N1 M0 |
|
Stade IV (NS) |
Tout T Tout N M1 |
Le pronostic d’une tumeur mammaire féline est directement dépendant de plusieurs facteurs clés identifiés lors de la démarche diagnostique. La quantification de ces facteurs permet de passer d’une estimation vague à un conseil plus précis pour le propriétaire, ce qui est fondamental pour obtenir un consentement éclairé sur les options de traitement.
Tableau 2 : Principaux Facteurs Pronostiques du Carcinome Mammaire Félin
|
Facteur Pronostique |
Impact si Défavorable |
|
Taille de la tumeur (> 3 cm) |
Survie médiane de 4 à 6 mois post-chirurgie. |
|
Statut des ganglions lymphatiques (N1) |
Facteur indépendant de mauvais pronostic, divise la survie par deux ou plus. |
|
Grade histologique (Grade III) |
Survie médiane de 5 à 13 mois (vs. 27-31 mois pour Grade I). |
|
Invasion lymphovasculaire (Présente) |
Facteur indépendant de mauvais pronostic, survie médiane < 9 mois. |
|
Ulcération cutanée (Présente) |
Facteur indépendant de mauvais pronostic, associé à une survie réduite. |
Traitement et prise en charge d’une tumeur mammaire chez le chat
La prise en charge thérapeutique des tumeurs mammaires chez la chatte est multimodale et doit être adaptée au stade de la maladie, à l’état général de l’animal et aux facteurs pronostiques. L’objectif principal pour une maladie localisée est le contrôle local et la prévention des métastases, tandis que pour une maladie avancée, l’accent est mis sur les soins palliatifs et le maintien du bien être.
L’exérèse chirurgicale agressive et complète constitue la pierre angulaire du traitement des tumeurs mammaires félines non métastatiques (Stades I à III). Le débat historique concernant l’étendue de la chirurgie est aujourd’hui largement tranché en faveur des approches les plus radicales. Des études rétrospectives ont démontré qu’une mastectomie radicale unilatérale (retrait de l’ensemble de la chaîne mammaire, du tissu sous-cutané associé et des ganglions lymphatiques régionaux axillaire et inguinal) ou, mieux encore, une mastectomie radicale bilatérale, offre un avantage significatif en termes de survie. La mastectomie bilatérale est associée à un temps de survie sans progression médian de 542 jours, contre seulement 289 jours pour la mastectomie unilatérale. Pour minimiser le risque de complications post-opératoires, notamment la tension sur la suture et la déhiscence de plaie, la mastectomie bilatérale peut être réalisée en deux interventions chirurgicales distinctes, espacées de quelques semaines.
Étant donné le haut potentiel métastatique des carcinomes félins, une thérapie adjuvante systémique est souvent envisagée après la chirurgie, particulièrement pour les tumeurs de grande taille (> 2-3 cm), de haut grade histologique (II ou III) ou en présence de métastases ganglionnaires. La chimiothérapie est la modalité la plus utilisée. La doxorubicine est la molécule de référence, administrée seule (par exemple, à la dose de 1 mg/kg par voie intraveineuse toutes les 3 semaines pour 4 à 5 cycles) ou en association avec le cyclophosphamide. Le carboplatine représente une alternative, notamment chez les chats présentant une cardiopathie préexistante. Cependant, le bénéfice réel de la chimiothérapie adjuvante reste un sujet de controverse dans la littérature vétérinaire. Certaines études rétrospectives suggèrent une amélioration de la survie, alors que d’autres, y compris des revues systématiques, n’ont pas pu démontrer de bénéfice statistiquement significatif. Cette absence de consensus clair représente un carrefour clinique et éthique. Elle contraint le praticien à une analyse bénéfice/risque individualisée pour chaque cas, mettant en balance un bénéfice de survie incertain contre les certitudes de la toxicité potentielle, du coût financier et du stress pour l’animal et son propriétaire. La décision devient moins l’application d’un protocole standard que le fruit d’une discussion éclairée, personnalisée en fonction du profil pronostique de la tumeur et des attentes du propriétaire.
D’autres approches thérapeutiques sont explorées. La radiothérapie a une place limitée, principalement pour le contrôle local de tumeurs non opérables ou en cas de marges chirurgicales incomplètes, mais il n’existe pas de protocoles standardisés. Les thérapies ciblées représentent une voie d’avenir. Le phosphate de toceranib (Palladia®), un inhibiteur de tyrosine kinase, a montré une activité clinique intéressante, hors AMM, en situation palliative pour les carcinomes mammaires macroscopiques ou métastatiques. Dans une étude, il a permis d’obtenir un bénéfice clinique chez près de 65 % des chats traités, avec un taux de réponse objective de 35 %. La chimiothérapie métronomique, qui utilise de faibles doses continues d’agents cytotoxiques pour un effet anti-angiogénique, n’a pas encore fait la preuve de sa supériorité.
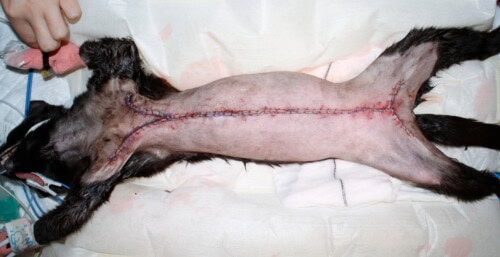
Aspect post-chirurgical (Crédit Laurent Findji)
Enfin, lorsque la maladie est au stade métastatique (Stade IV) ou que les traitements curatifs sont refusés ou contre-indiqués, la prise en charge se réoriente exclusivement vers les soins palliatifs. L’objectif est de préserver la meilleure qualité de vie possible en contrôlant la douleur, en stimulant l’appétit, en gérant les complications (comme le drainage d’un épanchement pleural) et en assurant une hydratation et une nutrition adéquates (par exemple, avec de l’eau fraîche et des aliments appétents).
Tableau 3 : Sélection de Protocoles Thérapeutiques Adjuvants et Palliatifs
|
Modalité |
Agent(s) |
Protocole Standard |
Indication Principale |
|
Chimiothérapie Adjuvante |
Doxorubicine |
1 mg/kg IV, toutes les 3 semaines, 4-5 cycles |
Post-chirurgie, haut risque (haut grade, N+, T>3cm) |
|
Chimiothérapie Adjuvante |
Carboplatine |
200-240 mg/m2 IV, toutes les 3-4 semaines, 4 cycles |
Alternative à la doxorubicine (ex: cardiopathie) |
|
Thérapie Ciblée (Palliative) |
Phosphate de Toceranib |
2.5-2.75 mg/kg PO, tous les 2 jours |
Maladie macroscopique non résécable ou métastatique |
|
Chimiothérapie (Palliative) |
Doxorubicine + Cyclophosphamide |
Doxo (cf. supra) + Cyclo (250 mg/m2 PO J3-6) |
Maladie non résécable/métastatique, recherche de réponse |
Prévention des tumeurs mammaires chez la chatte
La prévention des tumeurs mammaires chez la chatte est l’un des exemples les plus probants de l’efficacité de la médecine préventive en oncologie vétérinaire. La stratégie repose quasi exclusivement sur la gestion du statut hormonal de l’animal, principal facteur de risque modifiable.
Le principal et plus efficace des moyens de prévention est la stérilisation chirurgicale précoce (ovariohystérectomie). L’impact de cette intervention est spectaculaire : une chatte stérilisée avant l’âge de 6 mois, c’est-à-dire avant de connaître ses premières chaleurs, voit son risque de développer des tumeurs mammaires au cours de sa vie réduit de plus de 90 %. Ce bénéfice, exceptionnellement élevé, diminue ensuite avec l’âge de la stérilisation. Une intervention après les premières chaleurs mais avant l’âge d’un an réduit le risque d’environ 86 %. Bien que l’effet protecteur s’amenuise par la suite, la stérilisation reste bénéfique à tout âge. Ce lien direct et puissant entre une procédure de routine et la prévention d’un cancer mortel doit être un message central, non seulement comme une recommandation médicale mais comme un pilier de la possession responsable d’un animal de compagnie. Il transforme la gestion de cette maladie d’un problème de traitement réactif à une réussite de santé publique proactive.
Un autre aspect crucial de la prévention est l’éviction totale des hormones progestatives exogènes. L’utilisation de contraceptifs oraux ou injectables à base d’acétate de mégestrol ou de médroxyprogestérone est un facteur de risque majeur, non seulement pour les tumeurs malignes, mais aussi pour des affections bénignes comme la fibroadénomatose mammaire, une prolifération bénigne mais parfois spectaculaire du tissu mammaire. Ces produits sont donc à proscrire.
Enfin, la prévention secondaire passe par l’éducation des propriétaires et la détection précoce. Il convient d’encourager les propriétaires de chattes, surtout si elles sont non stérilisées ou stérilisées tardivement, à pratiquer une palpation régulière des chaînes mammaires de leur animal. La détection d’une petite anomalie doit motiver une consultation rapide. De même, un rendez-vous pour un examen de santé annuel, ou bi-annuel pour le groupe des chats seniors, est une mesure essentielle. Cet examen permet au vétérinaire de réaliser une palpation experte et de détecter des grosseurs à un stade précoce, où la taille est encore faible et le pronostic potentiellement bien meilleur.
Conclusion
Les tumeurs mammaires chez la chatte représentent une entité pathologique majeure en oncologie vétérinaire, dont la gravité est soulignée par une malignité dans la plupart des cas. La prise en charge de ces animaux de compagnie est un défi qui exige une approche rigoureuse et multimodale. Le succès thérapeutique repose sur un diagnostic précoce, facilité par la vigilance des propriétaires et des examens cliniques réguliers. Ce diagnostic doit impérativement être complété par une stadification clinique (système TNM) et une évaluation histopathologique approfondie, qui seule peut fournir les facteurs pronostiques déterminants que sont la taille de la tumeur, son grade histologique, et le statut des ganglions lymphatiques régionaux.
Le pilier du traitement pour la maladie localisée demeure une chirurgie agressive, la mastectomie radicale bilatérale s’imposant comme le standard de soin pour optimiser le contrôle local et prolonger la survie. Le débat sur le bénéfice de la chimiothérapie adjuvante reste ouvert, ce qui impose une décision au cas par cas, fruit d’un dialogue éclairé entre le clinicien et le propriétaire, en pesant soigneusement le pronostic de l’animal et l’impact du traitement sur sa qualité de vie. Pour les stades avancés, les thérapies ciblées émergentes et les soins palliatifs offrent des options précieuses pour maintenir le bien être. Au-delà du traitement, il est impératif de souligner que la prévention par la stérilisation précoce est d’une efficacité remarquable et doit rester un message de santé publique vétérinaire de premier plan.
Pistes de Recherche Futures
Pour continuer à améliorer la prise en charge du carcinome mammaire félin, plusieurs axes de recherche prioritaires doivent être explorés.
-
Essais Cliniques Prospectifs sur les Thérapies Adjuvantes : Il existe un besoin critique de mener des essais cliniques prospectifs, randomisés et contrôlés pour évaluer de manière définitive le bénéfice, les indications précises et les protocoles optimaux de la chimiothérapie adjuvante. Ces études devraient viser à identifier le sous-groupe de patientes (en fonction du stade, du grade, du statut des récepteurs) qui tire un réel avantage de ce traitement.
-
Validation de Biomarqueurs Moléculaires : La recherche doit s’intensifier pour identifier et valider des biomarqueurs moléculaires pronostiques et prédictifs. L’évaluation de l’expression de marqueurs comme HER2, Ki-67, et des récepteurs aux hormones (œstrogènes, progestérone) doit être standardisée. L’objectif est de s’orienter vers une médecine personnalisée, à l’image de ce qui est pratiqué pour le cancer du sein humain, afin de guider le choix des thérapies ciblées.
-
Développement de Thérapies Ciblées et d’Immunothérapies : Le chat, en tant que modèle spontané de cancer du sein agressif et souvent hormono-résistant, est un candidat idéal pour l’évaluation de nouvelles stratégies thérapeutiques. La recherche devrait explorer l’efficacité de nouveaux inhibiteurs de tyrosine kinase, d’agents anti-angiogéniques, et d’approches d’immunothérapie (comme les inhibiteurs de points de contrôle immunitaires) qui pourraient avoir des applications translationnelles pour les animaux et l’humain.
-
Standardisation et Affinement des Systèmes de Classification : Les efforts doivent se poursuivre pour affiner et valider internationalement les systèmes de grading histologique (comme les versions modifiées du système d’Elston et Ellis) et de stadification clinique (comme les nouvelles propositions basées sur le système AJCC humain). Une standardisation accrue est nécessaire pour améliorer la valeur pronostique de ces outils et permettre des comparaisons fiables entre les études.
-
Optimisation de l’Imagerie Diagnostique : Il serait pertinent d’évaluer l’apport des techniques d’imagerie avancée (tomodensitométrie avec injection de produit de contraste, IRM, TEP-scan) dans la détection précoce et sensible des métastases, notamment ganglionnaires et pulmonaires, ainsi que pour un suivi plus objectif de la réponse au traitement.
Références
-
Mills, K. L., et al. (2015). Prognostic Value of Histologic Grading for Feline Mammary Carcinoma: A Retrospective Survival Analysis. Veterinary Pathology, 52(2), 238–249.
-
Gemignani, F., et al. (2012). Proposed Classification of the Feline ‘Complex’ Mammary Tumors as Ductal and Intraductal Papillary Mammary Tumors. Veterinary Pathology, 49(6), 996-1001.
-
Zappulli, V., et al. (2019). Proposal for a Histological Staging System of Mammary Carcinomas in Dogs and Cats. Part 2. Frontiers in Veterinary Science, 6, 387.
-
Giménez, F., et al. (2023). Prognostic Insights in Feline Mammary Carcinomas: Clinicopathological Factors and the Proposal of a New Staging System. Animals, 13(10), 1649.
-
Pflaum, C. R., et al. (2018). Association of surgical approach with complication rate, progression-free survival time, and disease-specific survival time in cats with mammary adenocarcinoma: 107 cases (1991–2014). Journal of the American Veterinary Medical Association, 252(11), 1393-1402.
-
de Araújo, M. R., et al. (2018). Consensus for the diagnosis, prognosis and treatment of feline mammary tumors. Brazilian Journal of Veterinary Research and Animal Science, 55(2), e135084.
-
Seixas, F., et al. (2011). Anaplastic Mammary Carcinoma in Cat. Journal of Feline Medicine and Surgery, 13(5), 373-376.
-
Borrego, J. F., et al. (2009). Retrospective Evaluation of Adjunctive Doxorubicin for the Treatment of Feline Mammary Gland Adenocarcinoma: 67 Cases. Journal of Veterinary Internal Medicine, 23(5), 950-956.
-
Rassnick, K. M., et al. (2010). Evaluation of Adjuvant Doxorubicin-Based Chemotherapy for the Treatment of Feline Mammary Carcinoma. Journal of Veterinary Internal Medicine, 24(1), 222-226.
-
Mauldin, G. E., et al. (1988). Efficacy and Toxicity of Doxorubicin and Cyclophosphamide Used in the Treatment of Selected Malignant Tumors in 23 Cats. Journal of Veterinary Internal Medicine, 2(2), 60-65.
-
Ferreira, D., et al. (2024). Epidemiological and Clinicopathological Features of Feline Mammary Lesions. Veterinary Sciences, 11(11), 591.
-
Soares, M., et al. (2024). Consensus on the diagnosis, prognosis, and treatment of canine and feline mammary tumors: solid arrangement – 2023. Brazilian Journal of Veterinary Pathology, 17(3), 152-163.
-
Burrai, G. P., et al. (2010). Spontaneous Feline Mammary Carcinoma Is a Model of HER2-Overexpressing Poor-Prognosis Human Breast Cancer. Cancer Research, 70(19), 7547-7556.
-
Petrucci, G. N., et al. (2020). Metastatic feline mammary cancer: prognostic factors, outcome and comparison of different treatment modalities – a retrospective multicentre study. Journal of Feline Medicine and Surgery, 22(12), 1235-1244.
-
Martorell, J., et al. (2023). Evaluation of the efficacy and safety of toceranib phosphate in cats with macroscopic mammary adenocarcinoma. Journal of Feline Medicine and Surgery, 25(10).
-
Dias Pereira, P., et al. (2024). Metronomic Chemotherapy in Small Animal Oncology: Current Perspectives and Future Directions. Frontiers in Veterinary Science, 11, 1397376.
-
Sorenmo, K. U., et al. (2009). Canine and Feline Spontaneous Mammary Tumours as Models of Human Breast Cancer. Journal of Mammary Gland Biology and Neoplasia, 14(4), 369–381.
-
Van der Horst, A., et al. (2023). A Scoping Review on Tyrosine Kinase Inhibitors in Cats: Current Evidence and Future Directions. Animals, 13(19), 3059.
-
Beaufrère, H., et al. (2012). A systematic review of the evidence for a relationship between the age of neutering and the risk of mammary neoplasia in cats. Journal of the American Veterinary Medical Association, 241(3), 312-321.
-
Horta, R. S., et al. (2024). Level of Necrosis in Feline Mammary Tumors: How to Quantify, Why and for What Purpose?. Animals, 14(22), 3321.
-
Un cas de métastases cutanées d’un ADK pulmonaire chez un chat – DermaVet.
Recherches Connexes
tumeurs mammaires chat, mammite, infection, boule, différence, causes, mammifères, chatons, lactation, gestation, mamelons, lait, tétons, gonflement, prise de sang, grossesse, zone, infection bactérienne, bactéries, rendez vous, infection bactérienne, examen clinique
tumeurs mammaires chat
