La leishmaniose représente une maladie parasitaire complexe causée par un protozoaire du genre Leishmania, principalement Leishmania infantum dans le bassin méditerranéen et certaines régions d’Europe.
Comprendre la Leishmaniose du Chat
Qu’est-ce que la leishmaniose ?
La leishmaniose est une maladie parasitaire causée par le parasite Leishmania infantum, transmis par la piqûre d’un phlébotome
La leishmaniose représente une maladie parasitaire complexe causée par un protozoaire du genre Leishmania, principalement Leishmania infantum dans le bassin méditerranéen et certaines régions d’Europe. Cette affection, longtemps considérée comme spécifique aux canidés et aux humains, fait l’objet d’une attention croissante en médecine féline suite à l’augmentation des cas documentés chez les chats ces dernières décennies. Le parasite responsable, appartenant à la famille des Trypanosomatidae, est un organisme unicellulaire flagellé présentant deux formes distinctes au cours de son cycle biologique : la forme promastigote (flagellée) présente chez l’insecte vecteur et la forme amastigote (non flagellée) se développant dans les cellules du système phagocytaire mononucléé de l’hôte vertébré.
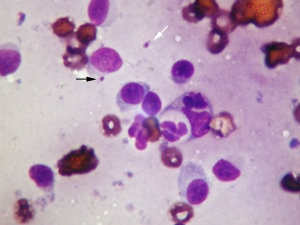
Leishmaniose (Photo MC Cadiergues)
La transmission de ce parasite s’effectue majoritairement via la piqûre d’un insecte hématophage appartenant à la famille des Psychodidae et au genre Phlebotomus (phlébotome). Lors d’un repas sanguin sur un hôte infecté, le phlébotome ingère des macrophages contenant des leishmanies sous forme amastigote. Ces parasites se transforment ensuite en promastigotes dans le tube digestif de l’insecte, s’y multiplient, puis migrent vers les pièces buccales. Lors d’un nouveau repas sanguin, ces promastigotes sont inoculés à un nouvel hôte vertébré, où ils sont phagocytés par les macrophages, se transforment en amastigotes et se multiplient dans ces cellules jusqu’à les détruire, pour ensuite infecter d’autres macrophages.
Les leishmanies, une fois dans l’organisme de l’hôte mammifère, sont capables de se propager à travers différents organes et tissus, développant des mécanismes d’échappement sophistiqués face au système immunitaire, ce qui contribue à la chronicité de l’infection et aux manifestations cliniques polymorphes caractéristiques de cette parasitose.
Elle peut affecter les chats, les chiens et les humains, et est considérée comme une zoonose
La leishmaniose constitue une zoonose d’importance majeure en santé publique et vétérinaire. Si le chien représente l’hôte réservoir principal de Leishmania infantum, le rôle épidémiologique du chat dans le cycle de transmission de ce parasite fait l’objet d’investigations croissantes. Plusieurs études sérologiques et moléculaires ont démontré que les félins domestiques peuvent être infectés par diverses espèces du genre Leishmania, dont L. infantum, L. mexicana ou L. braziliensis selon les régions géographiques concernées.
L’infection féline par Leishmania spp. présente des particularités notables comparativement à celle observée chez le chien. Les chats semblent développer une résistance naturelle plus marquée face aux leishmanies, expliquant potentiellement la prévalence moindre de la maladie clinique dans cette espèce. Chez les chiens, la leishmaniose se manifeste plus fréquemment par des lésions cutanées et des atteintes internes, avec l’apparition de symptômes spécifiques à cet animal. Cette résistance relative pourrait être attribuée à des caractéristiques génétiques ou immunologiques propres aux félins. Néanmoins, les chats immunodéprimés (infectés par le FIV ou FeLV, sous traitement immunosuppresseur, ou atteints d’affections débilitantes) présentent un risque accru de développer des formes cliniques de leishmaniose.
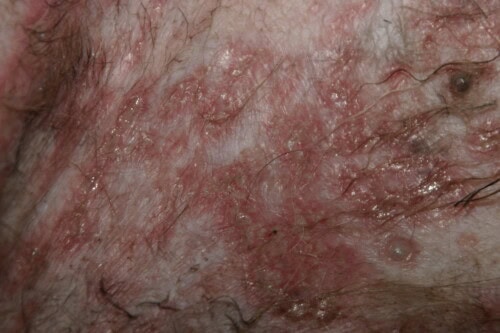

Sévères lésions de léishmaniose canine
Chez l’humain, la leishmaniose provoque différentes formes cliniques, allant de lésions cutanées localisées à des atteintes viscérales potentiellement fatales en l’absence de traitement approprié. La transmission à l’homme s’effectue principalement par l’intermédiaire du vecteur, mais des cas de transmission directe ont également été rapportés, notamment lors de transfusions sanguines ou de transplantations d’organes.
Il convient de souligner que la transmission directe du chat à l’homme n’a pas été formellement démontrée, mais les porteurs félins asymptomatiques pourraient constituer une source d’infection pour les phlébotomes, participant ainsi indirectement au cycle épidémiologique de cette parasitose.
La leishmaniose est une maladie chronique qui peut rester silencieuse pendant de longs mois ou même des années
La leishmaniose féline se caractérise par une évolution typiquement chronique, avec une phase subclinique pouvant s’étendre sur plusieurs mois, voire plusieurs années. Cette latence clinique s’explique par l’équilibre qui s’établit entre la multiplication parasitaire et la réponse immunitaire de l’hôte. Durant cette période d’incubation prolongée, les chats infectés demeurent généralement asymptomatiques mais peuvent héberger le parasite dans divers tissus, notamment la moelle osseuse, la rate, les ganglions lymphatiques et la peau.
Cette phase silencieuse constitue un défi diagnostique majeur pour les praticiens vétérinaires. En effet, les porteurs asymptomatiques ne présentent aucun signe clinique évocateur mais peuvent servir de réservoirs pour le parasite et contribuer à sa dissémination via les phlébotomes. Des études récentes suggèrent que la prévalence de l’infection asymptomatique chez les chats vivant en zone d’endémie pourrait être significativement plus élevée que celle des cas cliniques rapportés, soulignant l’importance du dépistage dans ces régions.
La rupture de cet équilibre hôte-parasite, souvent consécutive à une immunodépression ou à un stress physiologique important, peut conduire à la multiplication incontrôlée des leishmanies et à l’apparition progressive de manifestations cliniques. Cette progression de l’état subclinique vers la maladie clinique s’accompagne généralement d’une augmentation des charges parasitaires tissulaires et d’une exacerbation de la réponse inflammatoire, contribuant aux lésions organiques observées.
L’évolution naturelle de la leishmaniose féline clinique, en l’absence de traitement spécifique, reste insuffisamment documentée. Toutefois, les données disponibles suggèrent une progression généralement plus lente et moins sévère que chez le chien, avec néanmoins des cas d’évolution fatale rapportés dans la littérature, particulièrement chez les sujets immunodéprimés.
Épidémiologie de la leishmaniose
La leishmaniose est présente dans les régions méditerranéennes et en Amérique du Sud
La distribution géographique de la leishmaniose féline reflète largement celle des vecteurs compétents et suit des patterns épidémiologiques similaires à ceux observés chez le chien. Le bassin méditerranéen constitue une zone d’endémie majeure pour Leishmania infantum, avec des prévalences sérologiques chez les chats variant considérablement selon les études : de 0,6% à 59% en fonction des régions échantillonnées, des méthodes diagnostiques employées et des populations félines étudiées.
En Europe méridionale, les pays les plus touchés incluent l’Espagne, l’Italie, la Grèce, Chypre, Malte et le Portugal. En France, la leishmaniose est principalement établie dans le sud du pays, avec une prévalence plus élevée dans les départements méditerranéens. Des études récentes ont révélé des séroprévalences de 12% à 16% chez les chats dans certaines régions du sud de la France, confirmant l’importance de cette parasitose dans l’hexagone.
En Amérique du Sud, la situation épidémiologique se caractérise par une plus grande diversité d’espèces de Leishmania pathogènes pour les félins. Au Brésil, en Argentine et en Colombie notamment, des cas d’infection féline par L. infantum, mais également par L. braziliensis et L. amazonensis ont été documentés. Dans ces régions, les prévalences rapportées oscillent entre 3% et 25% selon les zones géographiques et les techniques de dépistage utilisées.
Des investigations récentes ont également mis en évidence la présence de leishmaniose féline dans des régions traditionnellement considérées comme non-endémiques, notamment dans certains pays d’Europe centrale et septentrionale. Cette expansion géographique, possiblement liée aux modifications des aires de répartition des vecteurs sous l’influence du réchauffement climatique, soulève de nouvelles interrogations quant à l’évolution future de cette parasitose.
Les phlébotomes sont les principaux vecteurs de la maladie et se trouvent principalement dans les zones rurales et les régions à forte densité de végétation
Les phlébotomes (Phlebotomus spp. en Europe et Lutzomyia spp. en Amérique) constituent les vecteurs biologiques indispensables au cycle de transmission naturel de Leishmania spp. Ces diptères nématocères de petite taille (2-3 mm) se distinguent par leur activité crépusculaire et nocturne, leur vol silencieux et saccadé, ainsi que par leur préférence pour les biotopes caractérisés par une hygrométrie élevée et des températures modérées.
L’écologie des phlébotomes présente des spécificités déterminantes pour l’épidémiologie de la leishmaniose. Ces insectes privilégient les zones rurales, péri-urbaines ou forestières offrant des microhabitats favorables à leur développement larvaire et à leur protection durant la journée. Les anfractuosités dans les murs de pierre, les terriers de rongeurs, les fissures dans le sol, les tas de bois et les zones de compostage constituent autant de gîtes potentiels pour ces vecteurs. La présence d’une végétation dense, maintenant une humidité relative élevée, favorise également leur prolifération.
Le rayon d’action des phlébotomes demeure relativement limité, généralement inférieur à 1 km autour de leur gîte de reproduction. Cette caractéristique explique la distribution souvent focale de la leishmaniose, avec des « points chauds » d’infection au sein même des zones d’endémie. L’activité des phlébotomes adultes présente une saisonnalité marquée dans les régions tempérées : en Europe méditerranéenne, elle s’étend typiquement de mai à octobre, avec un pic d’abondance durant les mois les plus chauds (juillet-août).
Seules les femelles phlébotomes sont hématophages et, par conséquent, vectrices potentielles de Leishmania spp. Ces dernières démontrent une certaine opportunité dans le choix de leurs hôtes, se nourrissant sur diverses espèces de mammifères, dont l’homme, le chien et le chat. Des études récentes suggèrent que certaines espèces de phlébotomes pourraient présenter une attractivité différentielle vis-à-vis des félins comparativement aux canidés, ce qui pourrait influencer la dynamique de transmission de la leishmaniose féline. Divers moyens de prévention sont mis en place pour limiter l’exposition aux phlébotomes dans les zones à risque.
Le réchauffement climatique peut contribuer à l’expansion de la maladie vers les régions plus froides
Le réchauffement climatique exerce une influence significative sur la distribution spatiale et temporelle des leishmanioses en modifiant les aires de répartition et la phénologie des vecteurs. L’augmentation des températures moyennes observée ces dernières décennies favorise l’extension géographique des phlébotomes vers des latitudes et des altitudes auparavant inadaptées à leur survie. Ce phénomène conduit à l’émergence ou à la réémergence de foyers de leishmaniose dans des régions historiquement indemnes.
En Europe, l’expansion septentrionale de Phlebotomus perniciosus et P. ariasi, principaux vecteurs de L. infantum, est désormais documentée dans plusieurs pays, dont la France, où ces insectes sont retrouvés dans des départements de plus en plus septentrionaux. Des modélisations prédictives, intégrant divers scénarios de changement climatique, suggèrent une progression potentielle de ces vecteurs jusqu’en Europe centrale et septentrionale d’ici 2050, avec pour corollaire une extension similaire des zones à risque pour la leishmaniose.
Outre l’extension spatiale, le réchauffement climatique induit également un allongement de la période d’activité saisonnière des phlébotomes. Dans certaines régions méditerranéennes, cette activité tend désormais à débuter plus précocement au printemps et à se prolonger plus tardivement en automne, augmentant ainsi la période pendant laquelle la transmission de Leishmania spp. est possible. Cette modification phénologique accroît le risque d’infection tant pour les populations animales que humaines.
L’augmentation des températures favorise également l’accélération du développement parasitaire (Leishmania spp.) au sein du vecteur, phénomène potentiellement amplificateur de la capacité vectorielle des phlébotomes. Des travaux expérimentaux ont démontré que l’élévation thermique raccourcit la période d’incubation extrinsèque du parasite, augmentant ainsi la proportion de phlébotomes infectants dans les populations vectrices.
La conjonction de ces différents mécanismes – expansion des vecteurs, allongement de leur période d’activité et accélération du développement parasitaire – constitue un facteur d’amplification significatif du risque leishmanien, ayant des implications majeures tant en médecine vétérinaire qu’en santé publique dans un contexte de changement climatique global.
Symptômes de la leishmaniose
Les symptômes de la leishmaniose chez le chat peuvent inclure des lésions cutanées, des ulcérations, des nodules et des croûtes
Les manifestations cutanées constituent la présentation clinique prédominante de la leishmaniose féline, étant rapportées dans approximativement 65% des cas cliniques documentés dans la littérature scientifique. Contrairement au chien où les lésions cutanées résultent principalement d’une réaction immunitaire à médiation cellulaire (dermatite granulomateuse), les lésions cutanées félines semblent plus fréquemment associées à la présence directe du parasite dans les tissus cutanés.
La sémiologie dermatologique de la leishmaniose chez le chat se caractérise par son polymorphisme. Les lésions primaires comprennent typiquement des nodules dermiques ou sous-cutanés, généralement fermes, non douloureux, de diamètre variable (2-15 mm), uniques ou multiples. Ces formations nodulaires peuvent évoluer vers l’ulcération, laissant place à des plaies chroniques non cicatrisantes, recouvertes de croûtes hémorragiques ou séro-hémorragiques.
La distribution lésionnelle présente certaines particularités, avec une prédilection pour les régions de la tête (truffe, pavillons auriculaires, paupières) et les extrémités des membres. Cette topographie suggère une corrélation avec les sites préférentiels de piqûre des phlébotomes. Des cas d’atteinte muqueuse, notamment au niveau de la cavité buccale et des conjonctives, ont également été documentés.
L’alopécie, généralement non prurigineuse et associée aux lésions nodulaires ou ulcératives, constitue un signe clinique fréquent. Des formes plus diffuses d’alopécie, évoquant une dermatite exfoliative, ont été occasionnellement rapportées, mais semblent moins caractéristiques que chez le chien.
Des modifications de la coloration cutanée, notamment une hyperpigmentation focale ou diffuse, et des anomalies de kératinisation (hyperkératose) peuvent compléter le tableau dermatologique. La présence concomitante de lésions compatibles avec d’autres dermatoses félines (complexe granulome éosinophilique, dermatite allergique) a été signalée dans certains cas, complexifiant parfois le diagnostic différentiel.
L’examen histopathologique des lésions cutanées révèle typiquement une réaction inflammatoire granulomateuse ou pyogranulomateuse, parfois associée à un infiltrat lymphoplasmocytaire. La mise en évidence d’amastigotes intramacrophagiques par coloration conventionnelle (May-Grünwald-Giemsa) ou immunohistochimie permet de confirmer l’étiologie leishmanienne.
Les chats peuvent également présenter des symptômes tels que la fièvre, la perte de poids, la fatigue et la dépression
Au-delà des manifestations cutanées, la leishmaniose féline peut s’accompagner d’un cortège de signes cliniques systémiques d’intensité variable. Ces symptômes, moins spécifiques, reflètent généralement la dissémination du parasite aux organes internes et l’établissement d’une réaction inflammatoire chronique multisystémique.
L’amaigrissement progressif, résultant d’une perte de poids pouvant atteindre 15 à 20% de la masse corporelle initiale, constitue un signe clinique fréquent, rapporté dans approximativement 40-50% des cas cliniques publiés. Cette altération de l’état corporel s’observe généralement malgré un appétit conservé, suggérant un état catabolique associé à l’inflammation chronique et à l’implication viscérale du processus pathologique.
La léthargie et la dépression, traduisant une altération de l’état général, accompagnent fréquemment le tableau clinique. Ces modifications comportementales se caractérisent par une réduction de l’activité spontanée, une diminution des interactions sociales et parfois une tendance à l’isolement. L’intensité de ces signes apparaît corrélée à la sévérité de l’atteinte systémique et à la présence éventuelle de complications organiques spécifiques.
Les épisodes fébriles, généralement intermittents et d’intensité modérée (40-40,5°C), s’observent dans environ 25-30% des cas cliniques. Ces accès thermiques, parfois associés à un syndrome pseudo-grippal (myalgies, arthralgie5), peuvent constituer le signe d’appel initial de l’affection ou accompagner les phases d’exacerbation au cours de l’évolution chronique.
L’existence d’une polyadénomégalie (hypertrophie des ganglions lymphatiques superficiels), localisée ou généralisée, a été rapportée dans 15-25% des cas de leishmaniose féline. Cette lymphadénopathie, habituellement indolore et de consistance ferme-élastique, reflète la réponse immunitaire lymphoplasmocytaire et histiocytaire face à la présence parasitaire.
Des anomalies des muqueuses, notamment la pâleur des muqueuses oculaires et gingivales traduisant une anémie sous-jacente, peuvent être observées. Plus rarement, un ictère (coloration jaunâtre des muqueuses) témoigne d’une atteinte hépatique ou d’une hémolyse associée au processus pathologique.
L’examen clinique approfondi peut également révéler une splénomégalie (augmentation du volume splénique) perceptible à la palpation abdominale, ainsi qu’une hépatomégalie moins fréquente, ces organomégalies traduisant l’infiltration de ces organes, notamment le foie, par des cellules inflammatoires et des leishmanies.
Les signes cliniques peuvent varier en fonction de la forme de la maladie et de la gravité de l’infection
La leishmaniose féline se caractérise par un polymorphisme clinique remarquable, reflétant la complexité des interactions entre le parasite, l’hôte félin et divers facteurs environnementaux. Cette variabilité sémiologique permet de distinguer plusieurs formes cliniques, dont l’expression dépend en grande partie de l’orientation de la réponse immunitaire de l’hôte face à l’infection parasitaire.
La forme cutanée localisée, caractérisée par des lésions dermatologiques circonscrites sans signes d’atteinte systémique, représente la présentation la plus fréquemment documentée chez le chat. Cette forme résulte généralement d’une réponse immunitaire à médiation cellulaire efficace, limitant la dissémination parasitaire aux tissus cutanés. L’expression clinique se limite alors à des lésions nodulaires, ulcératives ou croûteuses, généralement localisées aux sites d’inoculation par le phlébotome.
La forme cutanéo-muqueuse associe des lésions cutanées à une atteinte des muqueuses, particulièrement au niveau de la cavité buccale, des conjonctives et de la truffe. Cette présentation, moins fréquente, peut s’accompagner de complications spécifiques telles que stomatite, gingivite, blépharite ou rhinite, impactant significativement le confort et les fonctions physiologiques de l’animal.
La forme viscérale, caractérisée par une dissémination parasitaire aux organes internes sans lésions cutanées prédominantes, s’observe dans 15-20% des cas cliniques rapportés. Cette forme, généralement associée à une réponse immunitaire humorale excessive et inefficace, se traduit par des signes systémiques non spécifiques (amaigrissement, léthargie, fièvre) et des manifestations organiques spécifiques liées à l’atteinte hépatique, splénique ou médullaire.
La forme mixte ou systémique, combinant manifestations cutanées et viscérales, représente la forme clinique la plus sévère et potentiellement fatale. Elle résulte généralement d’une immunodépression préexistante (infection FIV/FeLV, traitement immunosuppresseur) ou induite par le parasite lui-même, conduisant à une multiplication incontrôlée des leishmanies dans de multiples tissus.
La sévérité des signes cliniques dépend de plusieurs facteurs déterminants, notamment la charge parasitaire, la virulence de la souche infectante, le statut immunitaire de l’hôte et l’ancienneté de l’infection. Les chats immunodéprimés présentent généralement des formes cliniques plus graves, avec une tendance accrue aux complications systémiques et un pronostic plus réservé.
L’apparition de lésions organiques spécifiques peut engendrer des syndromes cliniques particuliers. Ainsi, l’atteinte rénale peut conduire à une insuffisance rénale progressive caractérisée par polyurie-polydipsie, déshydratation et urémie. L’infiltration médullaire peut induire une pancytopénie se traduisant par anémie, leucopénie et thrombopénie. L’atteinte hépatique peut engendrer une cholestase ou une insuffisance hépatocellulaire.
Risques pour l’Homme et les autres animaux
La leishmaniose peut être transmise à l’Homme par la piqûre d’un phlébotome infecté
La leishmaniose constitue une zoonose d’importance majeure en santé publique, affectant annuellement environ 700 000 à 1 million de personnes dans le monde selon les données de l’Organisation Mondiale de la Santé. La transmission à l’Homme s’effectue principalement par l’intermédiaire des phlébotomes infectés, ces derniers pouvant s’être contaminés sur différents réservoirs mammifères, dont les félins.
Chez l’humain, l’infection par Leishmania infantum peut se manifester sous trois formes cliniques principales, dont l’expression dépend de facteurs parasitaires et surtout de la compétence immunitaire individuelle :
-
La leishmaniose cutanée, caractérisée par l’apparition de lésions papulo-nodulaires évoluant vers l’ulcération au site d’inoculation, généralement sur les parties découvertes du corps. Ces lésions, bien que souvent auto-résolutives en quelques mois, peuvent laisser des cicatrices indélébiles socialement stigmatisantes.
-
La leishmaniose cutanéo-muqueuse, forme clinique plus sévère marquée par une dissémination aux muqueuses naso-buccales avec destruction tissulaire potentiellement défigurante. Cette présentation, relativement rare en Europe méditerranéenne, s’observe plus fréquemment en Amérique latine.
-
La leishmaniose viscérale (kala-azar), forme systémique potentiellement fatale en l’absence de traitement approprié. Elle se caractérise par une fièvre ondulante, une splénomégalie, une hépatomégalie, une pancytopénie et une hypergammaglobulinémie. Cette forme clinique affecte particulièrement les individus immunodéprimés (co-infection VIH, traitements immunosuppresseurs) et les jeunes enfants. Les conséquences de la leishmaniose viscérale peuvent être particulièrement graves, avec un risque élevé de complications sévères, voire de décès en l’absence de prise en charge rapide.
Le risque zoonotique associé spécifiquement à la leishmaniose féline demeure insuffisamment caractérisé. Si le chat infecté peut théoriquement servir de source parasitaire pour les phlébotomes, son importance épidémiologique dans la transmission à l’Homme apparaît nettement inférieure à celle du chien pour plusieurs raisons :
-
La prévalence globale de l’infection féline semble significativement plus faible que chez le chien en zone d’endémie.
-
La charge parasitaire cutanée, déterminante pour l’infection du vecteur, s’avère généralement inférieure chez le chat comparativement au chien.
-
Les comportements d’hygiène féline (toilettage intensif) pourraient réduire la durée de présence des phlébotomes sur l’animal, limitant les opportunités de transmission.
Néanmoins, la vigilance s’impose, particulièrement en contexte d’immunodépression humaine (infection VIH, traitements immunosuppresseurs), où le contact avec des chats infectés pourrait représenter un facteur de risque additionnel. Les vétérinaires doivent sensibiliser les propriétaires de chats diagnostiqués à la composante zoonotique de cette affection, sans pour autant induire de panique injustifiée.
Les chiens sont les principaux porteurs et transmetteurs de la maladie, mais les chats peuvent également être infectés
Dans le cycle épidémiologique de Leishmania infantum, le chien domestique (Canis familiaris) occupe une position centrale en tant que réservoir principal du parasite. La leishmaniose canine, largement documentée dans toutes les régions endémiques, se caractérise par plusieurs aspects favorisant la transmission :
-
Une prévalence élevée en zone d’endémie, pouvant atteindre 30-40% des populations canines dans certains foyers méditerranéens.
-
Une charge parasitaire cutanée substantielle, même chez les sujets asymptomatiques, facilitant l’infection des phlébotomes lors du repas sanguin.
-
Une évolution chronique de l’infection avec persistance prolongée du parasite dans l’organisme, assurant une disponibilité parasitaire pour les vecteurs sur plusieurs années. En l’absence de traitement adapté, cette évolution chronique peut conduire à des conséquences graves, dont la mort du chien.
-
Une attractivité particulière des chiens pour certaines espèces de phlébotomes vectrices, liée potentiellement à des facteurs olfactifs spécifiques.
Comparativement, le rôle épidémiologique du chat domestique (Felis catus) dans le cycle de Leishmania infantum apparaît plus complexe et fait l’objet d’évaluations scientifiques récentes. Si les chats peuvent incontestablement être infectés par L. infantum, leur statut en tant que réservoir secondaire ou simple hôte accidentel demeure débattu. Plusieurs éléments méritent considération :
Des études expérimentales ont démontré que les chats infectés par L. infantum peuvent transmettre le parasite aux phlébotomes lors du repas sanguin. Cependant, l’efficacité de cette transmission semble inférieure à celle observée chez le chien, possiblement en raison d’une parasitémie cutanée moins importante.
La séroprévalence féline en zone d’endémie, bien que variable selon les études (0,6-59%), demeure généralement inférieure à celle rapportée chez le chien dans les mêmes régions, suggérant une sensibilité moindre à l’infection ou une exposition réduite aux vecteurs.
Certaines caractéristiques biologiques et comportementales félines pourraient limiter leur contribution au cycle épidémiologique : toilettage intensif réduisant la durée d’alimentation des phlébotomes, activité nocturne coïncidant avec celle des vecteurs mais exposant potentiellement moins les chats aux piqûres en raison de leur agilité.
Néanmoins, l’augmentation de la population féline dans certaines zones urbaines et péri-urbaines d’endémie, associée à la progression des cas cliniques documentés chez cette espèce, incite à reconsidérer le rôle épidémiologique potentiel du chat. Des études récentes utilisant des techniques moléculaires sensibles ont mis en évidence des prévalences d’infection féline significatives dans certains foyers méditerranéens, notamment dans des environnements où la densité canine est faible.
Les autres animaux, tels que les renards et les loups, peuvent également être infectés par la leishmaniose
L’écologie de Leishmania infantum implique un spectre d’hôtes vertébrés particulièrement diversifié, dépassant largement les seuls canidés domestiques. De nombreuses espèces de mammifères sauvages peuvent héberger ce parasite, contribuant potentiellement à maintenir des cycles enzootiques parallèles au cycle domestique classiquement décrit.
Parmi les canidés sauvages, le renard roux (Vulpes vulpes) apparaît comme un réservoir sylvatique significatif de L. infantum dans plusieurs régions méditerranéennes. Des études conduites en Espagne, en Italie et en France ont révélé des séroprévalences comprises entre 5% et 14%, avec identification du parasite par PCR dans différents tissus (peau, rate, moelle osseuse). La proximité phylogénétique entre renards et chiens se traduit par une sensibilité comparable à l’infection, bien que les formes cliniques semblent moins fréquentes chez les renards, possiblement en raison d’une meilleure adaptation co-évolutive.
Le loup (Canis lupus), espèce protégée en recolonisation dans certains territoires européens, présente également une sensibilité à L. infantum. Des séroprévalences de 20-25% ont été documentées dans des populations lupines d’Espagne et d’Italie, avec description occasionnelle de cas cliniques caractérisés par des manifestations cutanées et viscérales similaires à celles observées chez le chien domestique.
Au-delà des canidés, divers ordres de mammifères peuvent être affectés. Chez les lagomorphes, le lièvre ibérique (Lepus granatensis) a été identifié comme réservoir compétent lors d’une épidémie de leishmaniose humaine dans la région de Madrid. Cette découverte a révélé le potentiel adaptatif de L. infantum à exploiter de nouveaux hôtes vertébrés aptes à maintenir le cycle parasitaire.
Plusieurs espèces de rongeurs, notamment le rat noir (Rattus rattus) et la souris domestique (Mus musculus), présentent des taux d’infection non négligeables en zone d’endémie. Leur rôle épidémiologique reste cependant discuté, certains auteurs les considérant comme des hôtes accidentels plutôt que de véritables réservoirs.
Chez les chiroptères, certaines espèces de chauves-souris ont été trouvées naturellement infectées par Leishmania spp., soulevant d’intéressantes questions évolutives sur les adaptations parasitaires à ces hôtes phylogénétiquement distants des mammifères classiquement associés aux leishmanioses.
Parmi les périssodactyles, des cas d’infection par L. infantum ont été rapportés chez le cheval et l’âne, généralement sous forme d’atteintes cutanées localisées sans manifestations systémiques, suggérant une sensibilité réduite à l’infection disséminée.
Cette diversité d’hôtes mammifères sensibles à L. infantum souligne la complexité épidémiologique de cette parasitose et explique en partie les difficultés rencontrées dans les programmes de contrôle. La compréhension des cycles selvatiques et péri-domestiques impliquant ces diverses espèces constitue un enjeu majeur pour l’élaboration de stratégies préventives efficaces, tant en médecine vétérinaire qu’en santé publique.
Prévention de la leishmaniose chez le chat
La prévention de la leishmaniose chez le chat passe par la lutte contre les phlébotomes et la protection des chats contre les piqûres
La prévention de la leishmaniose féline repose fondamentalement sur une approche intégrée combinant plusieurs stratégies complémentaires visant à réduire l’exposition aux phlébotomes vecteurs. Contrairement à la situation chez le chien, où des protocoles préventifs standardisés sont bien établis, les mesures spécifiques pour les chats demeurent moins codifiées, nécessitant une adaptation aux particularités comportementales et physiologiques félines.
L’utilisation de produits répulsifs et/ou insecticides constitue la première ligne de défense contre les piqûres de phlébotomes. Cependant, la sensibilité particulière des félins à certaines molécules couramment employées chez les canidés (notamment les pyréthrinoïdes comme la perméthrine, hautement toxique pour les chats) impose une vigilance accrue dans la sélection des formulations antiparasitaires. À ce jour, les options spécifiquement validées pour les chats restent limitées, mais comprennent :
-
Les colliers imprégnés de fluméthrine et d’imidaclopride, dont l’efficacité répulsive contre les phlébotomes a été démontrée par des études expérimentales, avec une protection pouvant atteindre 6-8 mois. Leur acceptabilité par les félins demeure variable, certains chats manifestant une intolérance comportementale à ce dispositif.
-
Les formulations spot-on à base de fipronil, dont l’effet répulsif spécifique contre les phlébotomes reste modéré mais qui peuvent contribuer à la protection globale contre divers ectoparasites. Des associations avec d’autres molécules, comme le (S)-méthoprène ou le pyriproxyfène, peuvent augmenter le spectre d’action sans compromettre la sécurité d’emploi chez le chat.
Ces traitements antiparasitaires externes doivent être appliqués rigoureusement selon les recommandations du fabricant et maintenus pendant toute la saison d’activité des phlébotomes (généralement d’avril-mai à octobre-novembre en région méditerranéenne, avec des variations selon les conditions climatiques locales).
Parallèlement aux mesures de protection individuelle, des interventions environnementales peuvent réduire significativement la densité vectorielle dans l’habitat du chat :
-
Élimination ou modification des micro-habitats favorables aux stades immatures des phlébotomes : combler les fissures dans les murs, nettoyer régulièrement les zones d’accumulation de matière organique, réduire les tas de pierres ou de bois à proximité des habitations.
-
Installation de moustiquaires à maille fine (< 0,35 mm) sur les ouvertures des habitations, particulièrement efficaces compte tenu de la faible capacité de vol des phlébotomes.
-
Application sélective d’insecticides rémanents (ex : deltaméthrine) sur les surfaces murales intérieures et extérieures des habitations et des abris pour animaux, dans le respect des normes environnementales et sanitaires.
L’efficacité de ces mesures préventives dépend de leur application rigoureuse et de leur adaptation aux conditions épidémiologiques locales, justifiant une approche individualisée en fonction du risque régional et des spécificités de chaque situation.
Les chats doivent être gardés à l’intérieur, surtout pendant les heures de pointe des phlébotomes
La gestion des habitudes de vie et du mode de détention des chats joue un rôle déterminant dans la prévention de la leishmaniose féline, particulièrement en zone d’endémie établie. L’adaptation des pratiques d’élevage aux caractéristiques comportementales des phlébotomes permet de réduire significativement l’exposition aux vecteurs et, par conséquent, le risque d’infection.
La détention en intérieur strict constitue la mesure préventive la plus radicale et la plus efficace, éliminant virtuellement tout contact avec les phlébotomes. Cette stratégie, particulièrement recommandée pour les chats immunodéprimés (positifs au FIV ou FeLV, sous traitement immunosuppresseur) ou vivant dans des foyers hyperendémiques, se heurte cependant aux besoins comportementaux naturels des félins, notamment pour les sujets précédemment habitués à un accès extérieur. L’enrichissement environnemental du milieu intérieur (structures verticales, zones d’observations, jouets interactifs) s’avère alors essentiel pour préserver le bien-être psychologique de l’animal.
Une approche pragmatique, conciliant prévention et respect des besoins éthologiques félins, consiste à mettre en place des restrictions d’accès à l’extérieur ciblées sur les périodes de haute activité vectorielle. Les phlébotomes présentent un comportement nycthéméral caractéristique, avec un pic d’activité concentré sur les premières heures de la nuit (généralement entre le crépuscule et minuit). La limitation des sorties durant cette plage horaire réduit considérablement la probabilité de contact avec le vecteur. Concrètement, il est recommandé de rentrer les chats avant le coucher du soleil et de ne les autoriser à ressortir qu’après 22h-23h en période estivale dans les régions méditerranéennes.
Cette gestion temporelle des accès peut être facilitée par l’installation de chatières à contrôle horaire automatique, programmables selon les heures de forte activité vectorielle locale. Ces dispositifs présentent l’avantage de préserver une certaine autonomie pour l’animal tout en assurant une protection durant les phases critiques d’exposition.
La création d’espaces extérieurs sécurisés (enclos, terrasses ou jardins grillagés équipés de moustiquaires fines) représente une alternative intéressante, permettant un accès contrôlé à l’environnement extérieur tout en limitant l’exposition aux vecteurs. Ces aménagements doivent idéalement être complétés par des mesures de gestion environnementale visant à réduire la densité vectorielle dans ces espaces (élimination des microhabitats favorables aux phlébotomes, application ciblée d’insecticides).
L’efficacité de ces stratégies comportementales dépend de leur adaptation aux spécificités locales du cycle d’activité des phlébotomes, justifiant une personnalisation des recommandations en fonction des données entomologiques régionales.
Les propriétaires de chats doivent également prendre des mesures pour éliminer les phlébotomes de leur environnement
La gestion environnementale constitue un volet essentiel de l’approche préventive intégrée contre la leishmaniose féline. Les propriétaires peuvent mettre en œuvre diverses interventions écologiques et structurelles visant à réduire la densité vectorielle dans l’environnement immédiat de leur animal, complétant ainsi efficacement les mesures de protection individuelle.
L’aménagement paysager raisonné représente une première stratégie non chimique pertinente. Certaines caractéristiques végétales favorisent la prolifération des phlébotomes, notamment les haies denses, les massifs arbustifs compacts et les zones de végétation luxuriante maintenant une humidité élevée. La restructuration des espaces verts entourant l’habitation peut significativement réduire les habitats favorables aux vecteurs : élagage régulier des arbustes, maintien d’une distance entre les plantations et les murs, élimination des zones d’ombre excessive et de forte humidité, drainage des zones de stagnation d’eau.
La modification des structures bâties peut cibler spécifiquement les microhabitats larvaires des phlébotomes. Ces diptères privilégient pour leur développement les anfractuosités protégées riches en matière organique : fissures dans les murs, interstices entre les pierres, crevasses dans les rochers, terriers abandonnés. L’obturation des fissures murales, le jointoiement des pierres apparentes, l’élimination des tas de pierres ou de bois à proximité immédiate de l’habitation constituent des interventions efficaces pour réduire les sites de reproduction potentiels.
L’application d’insecticides rémanents sur les surfaces murales représente l’une des interventions environnementales les plus efficaces contre les phlébotomes adultes. Des formulations à base de pyréthrinoïdes (deltaméthrine, lambda-cyhalothrine) peuvent être appliquées sur les murs intérieurs et extérieurs des habitations et des abris pour animaux, particulièrement dans les zones de repos diurne potentielles des insectes (zones sombres, recoins abrités). Cette pulvérisation, réalisée idéalement avant le début de la saison d’activité vectorielle, peut conférer une protection pendant 3-6 mois selon les produits utilisés.
L’utilisation de pièges lumineux à UV équipés de systèmes électrocuteurs ou de surfaces collantes peut contribuer à réduire localement les populations de phlébotomes. Ces dispositifs, placés stratégiquement dans les zones de passage des vecteurs (près des ouvertures, dans les couloirs, à proximité des abris pour animaux), exploitent le phototropisme positif de ces insectes. Bien que leur efficacité demeure partielle, ils peuvent constituer un complément utile à d’autres mesures préventives, particulièrement dans les espaces clos comme les pièces à vivre ou les enclos extérieurs sécurisés.
Les diffuseurs d’insecticides en intérieur (plaquettes chauffantes, diffuseurs électriques) imprégnés de pyréthrinoïdes peuvent réduire efficacement la présence de phlébotomes dans les espaces habités. Leur utilisation doit cependant respecter scrupuleusement les consignes de sécurité, particulièrement en présence féline, en privilégiant les formulations spécifiquement validées comme non toxiques pour les chats.
L’efficacité de ces interventions environnementales dépend de leur application coordonnée et régulière, idéalement à l’échelle communautaire pour les zones à forte endémicité. Leur mise en œuvre raisonnée, respectant l’équilibre écologique et les normes sanitaires, constitue un élément clé de la prévention intégrée de la leishmaniose féline.
Traitement de la leishmaniose
Le traitement de la leishmaniose chez le chat dépend de la forme et de la gravité de la maladie
L’approche thérapeutique de la leishmaniose féline reste insuffisamment standardisée, contrairement à son homologue canine, en raison du nombre relativement limité de cas cliniques documentés et de l’absence d’essais cliniques à grande échelle. Le traitement doit être adapté à la présentation clinique spécifique, à la sévérité des manifestations et à l’état général du patient félin, tout en tenant compte des particularités pharmacologiques et physiologiques de l’espèce.
Pour les formes cutanées localisées, caractérisées par des lésions dermatologiques circonscrites sans signes d’atteinte systémique, une approche thérapeutique conservatrice peut être envisagée. Dans certains cas, l’excision chirurgicale complète des nodules cutanés isolés, lorsque leur localisation et leur taille le permettent, peut s’avérer curative sans nécessiter de traitement médicamenteux systémique. Cette option présente l’avantage d’éliminer rapidement le foyer parasitaire tout en évitant l’exposition potentiellement toxique à des agents leishmanicides.
Les formes cutanées multifocales ou disséminées nécessitent généralement une thérapeutique systémique. L’expérience clinique rapportée dans la littérature suggère l’efficacité de l’allopurinol administré à la posologie de 10-15 mg/kg deux fois par jour par voie orale pendant une durée minimale de 2-4 mois, parfois prolongée jusqu’à 6-12 mois selon l’évolution clinique. Cette molécule, inhibiteur de la xanthine oxydase interfèrent avec le métabolisme des purines de Leishmania spp., exerce un effet parasito-statique plutôt que parasiticide. Sa faible toxicité pour les félins en fait généralement le traitement de première intention, bien que son utilisation reste hors AMM dans cette espèce. Le suivi thérapeutique doit inclure une surveillance régulière de la fonction rénale, des potentielles xanthuries et cristalluries associées à son administration prolongée.
Les formes viscérales ou systémiques sévères peuvent nécessiter des protocoles thérapeutiques plus agressifs. L’utilisation d’antimoniate de méglumine (Glucantime®) à la posologie de 50 mg/kg une fois par jour par voie sous-cutanée pendant 20-30 jours a été rapportée chez quelques chats, avec une efficacité clinique satisfaisante. Cependant, ce traitement présente un risque potentiel de néphrotoxicité et d’hépatotoxicité plus élevé que l’allopurinol, imposant un monitoring biochimique rigoureux. La miltefosine (Milteforan®), administrée à 2 mg/kg une fois par jour per os pendant 28 jours, constitue une alternative prometteuse, avec un profil de tolérance apparemment favorable chez le chat, bien que l’expérience clinique reste limitée.
Pour les cas réfractaires aux monothérapies, des associations thérapeutiques peuvent être envisagées, notamment la combinaison allopurinol-antimoniate de méglumine, suivant des schémas adaptés de ceux utilisés chez le chien, avec les précautions nécessaires liées aux particularités métaboliques félines.
Les décisions thérapeutiques doivent également prendre en compte le statut immunitaire global du chat, particulièrement en cas d’infection concomitante par le FIV ou le FeLV, susceptible d’influencer à la fois la réponse au traitement et le risque d’effets indésirables médicamenteux.
Les médicaments tels que l’allopurinol peuvent être utilisés pour traiter les symptômes de la maladie
L’allopurinol constitue la pierre angulaire du traitement médical de la leishmaniose féline, bénéficiant de l’expérience clinique la plus substantielle dans cette indication. Cette molécule, analogue structural de l’hypoxanthine, exerce son action leishmaniostatique en s’incorporant dans l’ARN parasitaire, provoquant des erreurs de synthèse protéique et inhibant la multiplication du parasite. Contrairement aux agents leishmanicides directs, l’allopurinol ne permet généralement pas l’élimination complète des parasites mais instaure un contrôle de l’infection en réduisant significativement la charge parasitaire.
La posologie recommandée chez le chat varie selon les auteurs entre 10 et 20 mg/kg, administrée par voie orale toutes les 12 heures. Cette administration biquotidienne se justifie par la demi-vie relativement courte de la molécule chez les félins. Le traitement initial s’étend généralement sur 2-4 mois minimum, avec des extensions possibles jusqu’à 6-12 mois selon l’évolution clinique et parasitologique. Dans les cas de réponse favorable mais incomplète, un protocole d’entretien à jours alternés peut être instauré pour une durée prolongée, parfois indéterminée en cas de risque élevé de rechute.
L’efficacité clinique de l’allopurinol se traduit généralement par une amélioration des signes cutanés dans les 4-8 semaines suivant l’initiation du traitement. La régression des nodules, la cicatrisation des ulcérations et la repousse du pelage constituent des marqueurs objectifs de réponse thérapeutique. L’amélioration des paramètres hématologiques et biochimiques (correction de l’anémie, normalisation des protéines sériques) s’observe généralement dans un délai similaire ou légèrement plus long.
Malgré un profil de tolérance globalement favorable, l’administration prolongée d’allopurinol n’est pas dénuée d’effets indésirables potentiels chez le chat. La xanthinurie, résultant de l’inhibition de la xanthine oxydase, peut conduire à la formation de cristaux ou de calculs xanthiques, notamment chez les sujets prédisposés aux urolithiases. Cette complication justifie une surveillance régulière de la fonction rénale et des analyses urinaires périodiques (recherche de cristallurie, mesure du rapport protéine/créatinine urinaire). Des élévations modérées et transitoires des enzymes hépatiques ont également été rapportées, nécessitant un suivi biochimique régulier.
Des réactions idiosyncrasiques cutanées (érythème, prurit) ou digestives (vomissements, diarrhée) peuvent survenir dans les premiers jours de traitement, généralement sans gravité et résolutives à l’arrêt du médicament. La reprise progressive du traitement à dose réduite peut permettre dans certains cas de surmonter ces intolérances initiales.
L’émergence de résistances parasitaires à l’allopurinol, documentée chez l’homme et suspectée chez le chien dans certaines régions hyperendémiques, n’a pas été formellement caractérisée chez le chat. Néanmoins, cette éventualité doit être considérée face à l’absence de réponse clinique après 4-8 semaines de traitement bien conduit ou en cas de rechute précoce après arrêt thérapeutique.
Un suivi régulier est nécessaire pour surveiller la progression de la maladie et ajuster le traitement en conséquence
Le management thérapeutique optimal de la leishmaniose féline requiert une approche structurée de suivi clinique, paraclinique et parasitologique, permettant d’évaluer objectivement l’efficacité du traitement, de détecter précocement d’éventuelles complications et d’adapter la stratégie thérapeutique en fonction de l’évolution individuelle de chaque patient.
Le protocole de suivi doit débuter par une évaluation complète avant initiation du traitement, établissant une référence pour les comparaisons ultérieures. Cette évaluation initiale comprend idéalement :
-
Un examen clinique approfondi avec documentation précise des lésions cutanées (photographies, mesures dimensionnelles, cartographie lésionnelle) et quantification des signes systémiques (score corporel, température, état d’hydratation).
-
Un bilan hématologique et biochimique complet, incluant numération-formule sanguine, profil protéique (protéines totales, albumine, rapport albumine/globulines), fonction rénale (urée, créatinine, SDMA), enzymes hépatiques et électrolytes.
-
Une analyse urinaire complète, avec mesure de la densité, analyse du sédiment et détermination du rapport protéine/créatinine urinaire.
-
Une évaluation quantitative ou semi-quantitative de la charge parasitaire, par cytologie (ponction de moelle osseuse, ganglions, lésions cutanées), PCR quantitative ou sérologie quantitative.
Durant la phase thérapeutique active, des contrôles cliniques mensuels sont recommandés pendant les 3 premiers mois, puis trimestriels en cas d’évolution favorable. Chaque visite doit comporter une évaluation clinique complète, avec documentation objective de l’évolution des lésions et des signes systémiques. Des bilans hématologiques et biochimiques périodiques (initialement mensuels puis trimestriels) permettent de surveiller l’efficacité thérapeutique sur les anomalies paracliniques préexistantes et de détecter d’éventuels effets indésirables médicamenteux.
L’évaluation de la réponse parasitologique, par PCR quantitative ou sérologie quantitative, est généralement recommandée après 3-4 mois de traitement, puis tous les 6 mois. Une diminution significative de la charge parasitaire ou des titres d’anticorps constitue un indicateur objectif d’efficacité thérapeutique, même si l’élimination parasitaire complète reste rare avec les protocoles actuels.
La durée optimale du traitement demeure indéterminée et doit être individualisée selon la réponse clinique et parasitologique. Une résolution complète des signes cliniques, associée à une normalisation des paramètres hématologiques et biochimiques et à une diminution significative de la charge parasitaire, peut justifier l’arrêt progressif du traitement après 6-12 mois. Néanmoins, un suivi post-thérapeutique rigoureux s’impose, avec contrôles cliniques et paracliniques trimestriels pendant au moins un an, pour détecter précocement d’éventuelles rechutes.
Face à une réponse thérapeutique insuffisante après 2-3 mois de traitement bien conduit (persistance ou aggravation des signes cliniques, absence de diminution de la charge parasitaire), plusieurs ajustements peuvent être envisagés : augmentation de la posologie (dans les limites de la tolérance), prolongation de la durée thérapeutique initialement prévue, ou modification du protocole avec recours à des associations médicamenteuses ou à des molécules alternatives comme l’antimoniate de méglumine ou la miltefosine.
Le suivi post-thérapeutique à long terme demeure essentiel, même après résolution clinique complète, en raison du risque de persistance parasitaire et de rechutes tardives. Un contrôle clinique et paraclinique semestriel est généralement recommandé pendant au moins 2-3 ans, puis annuel en l’absence de récidive.
Diagnostic de la leishmaniose
Le diagnostic de la leishmaniose chez le chat peut être difficile en raison de la similitude des symptômes avec d’autres maladies
L’établissement d’un diagnostic définitif de leishmaniose féline constitue un défi clinique substantiel, principalement en raison du polymorphisme sémiologique de cette affection et des similitudes cliniques avec diverses dermatoses et affections systémiques félines. Cette complexité diagnostique explique probablement la sous-reconnaissance de cette parasitose dans l’espèce féline, nécessitant une approche méthodique et multimodale pour sa confirmation.
Le diagnostic différentiel des formes cutanées de leishmaniose féline doit inclure de nombreuses affections dermatologiques produisant des lésions nodulaires, ulcératives ou croûteuses. Les néoplasmes cutanés, particulièrement le carcinome épidermoïde, le mastocytome et divers sarcomes, miment fréquemment l’apparence clinique des lésions leishmaniennes. Le complexe granulome éosinophilique félin, dans ses diverses présentations (plaque, granulome, ulcère), partage également des similarités sémiologiques notables. Les dermatophytoses, les mycoses profondes (cryptococcose, sporotrichose), les infections bactériennes (pyodermite, mycobactérioses), les dermatoses auto-immunes (pemphigus, lupus cutané) et certaines réactions médicamenteuses complètent ce diagnostic différentiel exhaustif.
Pour les présentations systémiques, caractérisées par des signes non spécifiques comme l’amaigrissement, la léthargie ou la fièvre, le diagnostic différentiel demeure particulièrement vaste. Les principales entités à considérer incluent les viroses félines immunosuppressives (FIV, FeLV), les mycoses systémiques, la péritonite infectieuse féline, diverses néoplasies (lymphome, carcinomatose), certaines endocrinopathies (hyperthyroïdie) et néphropathies chroniques.
Face à cette diversité étiologique potentielle, l’anamnèse et l’examen clinique représentent les premières étapes cruciales de la démarche diagnostique. L’historique de séjour ou de résidence en zone d’endémie leishmanienne, l’exposition à des activités nocturnes durant la saison d’activité des phlébotomes, et la présence d’autres cas (félins ou canins) dans l’environnement constituent des éléments épidémiologiques orientatifs. L’examen clinique minutieux doit s’attacher à caractériser précisément les lésions dermatologiques et à rechercher des signes systémiques associés (lymphadénopathie, splénomégalie, amaigrissement, muqueuses pâles) pouvant renforcer la suspicion.
Les examens hématologiques et biochimiques fournissent des éléments d’orientation supplémentaires, bien que rarement pathognomoniques. Les anomalies les plus fréquemment rapportées incluent une anémie non régénérative modérée, une leucopénie ou leucocytose, une thrombocytopénie, une hyperprotéinémie avec hypergammaglobulinémie (profil électrophorétique polyclonal ou oligoclonal), une hypoalbuminémie et des perturbations variables des paramètres rénaux et hépatiques selon l’implication de ces organes.
La confirmation diagnostique reposera in fine sur des méthodes spécifiques permettant la mise en évidence directe ou indirecte du parasite, dont la sensibilité et la spécificité variables justifient souvent une approche combinée, particulièrement dans les cas cliniquement équivoques.
Les tests sérologiques et les examens histopathologiques peuvent être utilisés pour confirmer le diagnostic
La confirmation diagnostique de la leishmaniose féline repose sur diverses méthodes complémentaires, chacune présentant des avantages et limitations spécifiques. L’approche optimale combine généralement plusieurs techniques pour maximiser la sensibilité et la spécificité du diagnostic.
Les méthodes sérologiques, visant la détection des anticorps anti-Leishmania, constituent souvent l’approche diagnostique initiale en raison de leur accessibilité et de leur caractère peu invasif. Plusieurs techniques sont disponibles :
-
L’immunofluorescence indirecte (IFI), considérée comme référence sérologique, détecte les anticorps spécifiques avec une sensibilité globalement satisfaisante (70-90%) et une excellente spécificité (> 95%) lorsqu’un seuil approprié est utilisé. Cependant, chez le chat, la standardisation des seuils de positivité demeure incomplète, avec des valeurs proposées généralement entre 1:40 et 1:80. Des titres faibles (< 1:160) doivent être interprétés avec prudence, pouvant représenter des réactions croisées ou des expositions anciennes sans infection active.
-
La technique ELISA, disponible en différents formats commerciaux, présente des performances similaires à l’IFI mais offre l’avantage d’une plus grande standardisation et d’une quantification plus précise. Des adaptations spécifiques pour l’espèce féline ont été développées récemment, optimisant la détection des immunoglobulines félines anti-Leishmania.
-
L’immunochromatographie rapide, proposée sous forme de tests commerciaux prêts à l’emploi, offre une solution diagnostique rapide en contexte clinique. Cependant, ces tests, initialement développés pour les canidés, présentent une sensibilité réduite chez le chat (60-70%), justifiant une confirmation par d’autres méthodes en cas de résultat négatif malgré une forte suspicion clinique.
Les limites des approches sérologiques incluent les potentielles séronégativités observées en début d’infection (fenêtre sérologique) ou chez certains sujets anergiques, ainsi que la persistance d’anticorps après résolution de l’infection active, complexifiant l’interprétation en contexte de suivi thérapeutique.
L’examen histopathologique des lésions cutanées ou des organes affectés représente une approche diagnostique complémentaire particulièrement pertinente face aux lésions cliniquement accessibles. Les prélèvements biopsiques, fixés et colorés conventionnellement (hématoxyline-éosine), révèlent typiquement une dermatite granulomateuse ou pyogranulomateuse, parfois avec composante neutrophilique ou lymphoplasmocytaire. La mise en évidence d’amastigotes intramacrophagiques (corps de Leishman-Donovan) constitue l’élément diagnostique déterminant, bien que leur visualisation puisse s’avérer difficile en cas de faible charge parasitaire. Des colorations spéciales (Giemsa) ou l’immunohistochimie utilisant des anticorps anti-Leishmania augmentent significativement la sensibilité de cette approche.
L’examen cytologique de ponctions d’organes potentiellement infectés (moelle osseuse, ganglions lymphatiques, rate) ou d’impressions/raclages de lésions cutanées peut également permettre la visualisation directe des amastigotes. Cette approche, relativement simple et rapide, présente cependant une sensibilité limitée (30-50% selon les études), particulièrement chez le chat où la charge parasitaire apparaît généralement inférieure à celle observée chez le chien pour un tableau clinique comparable.
L’isolement parasitaire par culture in vitro sur milieux spécifiques (NNN, RPMI) à partir de fragments tissulaires ou d’aspirations médullaires/ganglionnaires constitue une méthode diagnostique définitive. Cette technique, réservée aux laboratoires spécialisés, présente une spécificité excellente mais une sensibilité variable (60-85%) et se révèle chronophage, les cultures nécessitant plusieurs semaines d’observation.
Les vétérinaires doivent également prendre en compte les antécédents médicaux et les facteurs de risque du chat
L’intégration des données anamnestiques, épidémiologiques et cliniques constitue une étape fondamentale dans l’évaluation diagnostique de la leishmaniose féline, permettant d’orienter judicieusement les investigations complémentaires et d’interpréter adéquatement leurs résultats. Cette approche holistique s’avère particulièrement pertinente face à une affection dont les manifestations cliniques peuvent être protéiformes et les résultats diagnostiques parfois équivoques.
L’analyse des facteurs de risque épidémiologiques doit être systématique et minutieuse. La résidence actuelle ou antérieure dans une zone endémique pour la leishmaniose constitue un élément essentiel de l’évaluation. Les régions méditerranéennes françaises (Provence-Alpes-Côte d’Azur, Occitanie, Corse) présentent une endémicité établie, avec des prévalences variables selon les foyers géographiques précis. Les déplacements/voyages en zone d’endémie, particulièrement durant la saison d’activité vectorielle (mai-octobre), doivent également être documentés, même pour des séjours relativement brefs.
Le mode de vie du chat influence significativement son niveau d’exposition aux phlébotomes vecteurs. Les félins ayant un accès permanent ou régulier à l’extérieur, particulièrement durant les heures crépusculaires et nocturnes, présentent un risque accru. La présence de microhabitats favorables aux phlébotomes dans l’environnement immédiat (murs en pierre, anfractuosités, zones végétalisées denses, humidité élevée) constitue un facteur amplificateur supplémentaire. La cohabitation avec d’autres animaux, notamment des chiens leishmaniose-positifs, représente également un facteur de risque épidémiologique significatif.
Le statut immunitaire du patient constitue un déterminant majeur de la susceptibilité à l’infection leishmanienne et de son expression clinique. L’investigation diagnostique doit systématiquement rechercher des causes d’immunodépression potentielle :
-
Infections virales immunosuppressives (FIV, FeLV), dont la prévalence peut atteindre 5-15% dans certaines populations félines à risque.
-
Traitements immunosuppresseurs (corticostéroïdes, cyclosporine, agents cytotoxiques) administrés pour des affections concomitantes.
-
Affections débilitantes chroniques (insuffisance rénale, diabète, néoplasies) susceptibles d’altérer les défenses immunitaires.
-
Statut nutritionnel et conditions générales d’entretien, influençant la compétence immunitaire globale.
Le recensement exhaustif des manifestations cliniques antérieures potentiellement compatibles avec une leishmaniose peut fournir des éléments d’orientation chronologique précieux. Des épisodes non diagnostiqués de lésions cutanées récidivantes, des phases d’altération de l’état général inexpliquées ou des anomalies biologiques persistantes (anémie, hyperglobulinémie) peuvent constituer rétrospectivement des indices évocateurs d’une infection leishmanienne préexistante.
L’évaluation de la réponse à d’éventuels traitements antérieurs, particulièrement antibiothérapies, corticothérapies ou antifongiques prescrits empiriquement pour des lésions finalement attribuables à la leishmaniose, peut également éclairer la démarche diagnostique. Une résistance aux antibiothérapies conventionnelles, une amélioration transitoire sous corticostéroïdes suivie d’une exacerbation à l’arrêt, ou l’échec des antifongiques systémiques constituent autant d’éléments anamnestiques orientatifs.
Évolution et pronostic
L’évolution de la leishmaniose chez le chat peut varier en fonction de la forme et de la gravité de la maladie
L’histoire naturelle de la leishmaniose féline se caractérise par une hétérogénéité évolutive marquée, reflétant la complexité des interactions entre le parasite, l’hôte félin et divers facteurs environnementaux. Cette diversité de trajectoires cliniques nécessite une approche pronostique individualisée, prenant en compte les spécificités de chaque cas.
La forme cutanée localisée présente généralement l’évolution la plus favorable. Caractérisée par des lésions dermatologiques circonscrites sans signes d’atteinte systémique, cette forme peut parfois connaître une résolution spontanée, particulièrement chez les sujets immunocompétents. Des études de suivi ont documenté des cas de régression complète des lésions nodulaires après plusieurs mois, sans traitement spécifique. Toutefois, cette évolution favorable demeure imprévisible et ne peut être anticipée avec certitude, justifiant généralement une intervention thérapeutique malgré cette potentialité auto-résolutive.
La forme cutanée multifocale, caractérisée par des lésions dermatologiques disséminées sans atteinte viscérale significative, présente une évolution plus variable. Sans traitement, une progression lente des lésions est généralement observée, avec apparition de nouvelles localisations et extension des lésions préexistantes. Cette évolution peut s’accompagner d’une altération progressive de l’état général, même en l’absence d’atteinte viscérale documentée. Sous traitement approprié, l’amélioration clinique s’observe généralement dans les 4-8 semaines, avec résolution complète possible en 3-6 mois selon la sévérité initiale et la réponse individuelle.
La forme viscérale, impliquant une dissémination parasitaire aux organes internes, présente le pronostic le plus réservé. Son évolution naturelle, en l’absence d’intervention thérapeutique, conduit généralement à une détérioration progressive de l’état général avec développement potentiel de complications organiques spécifiques. L’atteinte rénale, particulièrement redoutée, peut évoluer vers une insuffisance rénale chronique irréversible, déterminant largement le pronostic vital. L’infiltration médullaire peut induire une myélosuppression avec pancytopénie, augmentant le risque de complications hémorragiques et infectieuses secondaires.
Les formes atypiques, notamment oculaires ou neurologiques, présentent des évolutions spécifiques conditionnées par les structures anatomiques impliquées. L’uvéite leishmanienne peut conduire à des séquelles visuelles permanentes sans prise en charge ophtalmologique spécialisée. Les rares cas d’atteinte neurologique documentés suggèrent un pronostic particulièrement réservé, avec réponse thérapeutique souvent limitée et séquelles neurologiques fréquentes.
La temporalité évolutive de la leishmaniose féline se caractérise généralement par une progression lente, sur plusieurs mois à plusieurs années. Cette chronicité constitue à la fois un avantage, permettant des interventions thérapeutiques avant détérioration majeure, et un inconvénient, imposant des suivis prolongés et compliquant l’évaluation objective des réponses thérapeutiques.
Les facteurs modulant cette évolution incluent le statut immunitaire (les co-infections par FIV/FeLV accélérant significativement la progression), l’âge (les sujets âgés présentant généralement des évolutions moins favorables), la précocité du diagnostic et de l’intervention thérapeutique, ainsi que la virulence intrinsèque de la souche parasitaire impliquée, bien que ce dernier facteur demeure difficile à évaluer en pratique clinique.
Les chats qui reçoivent un traitement approprié peuvent récupérer complètement, mais la maladie peut également être chronique
Les données de suivi longitudinal de chats traités pour leishmaniose, bien que limitées comparativement à l’espèce canine, permettent d’esquisser plusieurs trajectoires évolutives possibles sous traitement spécifique. Cette hétérogénéité de réponses thérapeutiques souligne l’importance d’une approche individualisée et d’un monitoring clinico-biologique rigoureux.
La résolution clinique complète, caractérisée par la disparition de toutes les manifestations symptomatiques et la normalisation des paramètres biologiques préalablement altérés, s’observe dans approximativement 60-70% des cas traités selon les études disponibles. Cette évolution favorable se manifeste généralement par une amélioration progressive des lésions cutanées (réduction de taille, ré-épithélialisation des ulcérations, repousse du pelage) dans les 4-8 premières semaines de traitement, suivie d’une normalisation des paramètres hématologiques et biochimiques en 2-4 mois. L’utilisation d’allopurinol en monothérapie (10-15 mg/kg BID) pendant 4-6 mois permet d’atteindre cette résolution clinique dans la majorité des cas de formes cutanées localisées ou modérément disséminées chez les sujets immunocompétents.
La réponse partielle, définie par une amélioration significative mais incomplète des signes cliniques et/ou des anomalies paracliniques, concerne environ 20-25% des cas. Cette évolution intermédiaire peut se manifester par la persistance de certaines lésions cutanées atténuées ou par la normalisation clinique sans résolution complète des anomalies biologiques (hypergammaglobulinémie persistante, anémie modérée résiduelle). Ces cas nécessitent généralement une prolongation du traitement initial (6-12 mois) ou l’adoption d’un protocole d’entretien à long terme (allopurinol à jours alternés ou en administration hebdomadaire) pour maintenir le contrôle de l’infection.
L’échec thérapeutique primaire, caractérisé par l’absence d’amélioration clinique significative après 2-3 mois de traitement bien conduit, concerne approximativement 5-10% des cas. Cette situation peut résulter de plusieurs facteurs : résistance parasitaire aux molécules utilisées, immunodépression sévère limitant l’efficacité thérapeutique, atteintes organiques irréversibles préexistantes, ou mauvaise observance du traitement. Face à cette situation, un ajustement thérapeutique s’impose, généralement vers des protocoles combinés (allopurinol + antimoniate de méglumine ou miltefosine) sous surveillance étroite.
Les récidives après arrêt thérapeutique, définies par la réapparition de signes cliniques après une période de rémission complète, concernent environ 15-30% des cas selon les séries publiées. Ces récidives surviennent généralement dans les 6-12 mois suivant l’interruption du traitement, mais des réactivations plus tardives ont été documentées. Leur fréquence semble corrélée à la durée du traitement initial (plus élevée après traitements courts < 4 mois), à la persistance d’anomalies paracliniques malgré la résolution clinique, et au statut immunitaire de l’animal. Les récidives répondent généralement favorablement à la réintroduction du protocole thérapeutique initial, mais peuvent justifier des traitements plus prolongés, voire permanents dans certains cas.
La tolérance aux traitements anti-leishmaniens chez le chat apparaît globalement satisfaisante. L’allopurinol, molécule de choix en première intention, présente un profil d’effets indésirables dominé par des manifestations digestives mineures (vomissements, inappétence) et des élévations modérées et transitoires des enzymes hépatiques, rarement limitantes pour la poursuite du traitement. La xanthinurie induite nécessite une surveillance urinaire régulière sans généralement compromettre l’utilisation prolongée de cette molécule.
Le pronostic est généralement réservé pour les chats qui développent des complications graves ou qui ne reçoivent pas de traitement approprié
L’établissement d’un pronostic précis pour les chats atteints de leishmaniose doit intégrer de multiples variables cliniques, paracliniques et épidémiologiques. Cette évaluation pronostique, essentielle pour guider les décisions thérapeutiques et les communications avec les propriétaires, demeure néanmoins empreinte d’incertitudes liées à la variabilité individuelle des réponses face à cette parasitose complexe.
Le développement de complications organiques spécifiques constitue un déterminant majeur du pronostic. L’atteinte rénale, caractérisée par une glomérulonéphrite à immuns complexes pouvant évoluer vers une insuffisance rénale chronique, représente la complication la plus péjorative en termes pronostiques. La présence d’une protéinurie persistante (ratio protéine/créatinine urinaire > 0,5), d’une azotémie (créatinine > 180 μmol/l, SDMA > 18 μg/dl) ou d’une incapacité à concentrer les urines (densité urinaire < 1,035) assombrit significativement le pronostic vital à moyen terme. L’évolution vers une insuffisance rénale terminale, généralement irréversible malgré le contrôle de l’infection leishmanienne sous-jacente, constitue une cause majeure de mortalité dans ce contexte.
Les complications hématologiques sévères, notamment pancytopénie profonde par myélosuppression directe ou immune-médiée, s’accompagnent également d’un pronostic réservé. L’anémie sévère (hématocrite < 15%), la neutropénie marquée (< 1000 neutrophiles/μl) ou la thrombocytopénie profonde (< 50 000 plaquettes/μl) augmentent significativement les risques de complications secondaires potentiellement fatales (infections opportunistes, hémorragies) et compliquent la mise en œuvre thérapeutique par leurs effets limitants sur la tolérance médicamenteuse.
L’immunodépression sous-jacente, particulièrement liée aux infections rétrovirales félines (FIV, FeLV), constitue un facteur pronostique majeur. Les chats co-infectés présentent typiquement des réponses thérapeutiques moins complètes, des durées de rémission plus courtes et des taux de récidive significativement supérieurs comparativement aux sujets séronégatifs. La charge virale (notamment pour le FeLV) et le degré d’immunodépression clinique et paraclinique (rapport CD4/CD8 pour le FIV) modulent cette influence pronostique négative.
L’absence ou le retard de diagnostic et de prise en charge thérapeutique appropriée influence considérablement le devenir clinique. Les cas diagnostiqués tardivement, après développement de complications organiques irréversibles, présentent logiquement un pronostic plus sombre. Cette réalité souligne l’importance de la sensibilisation des praticiens vétérinaires à cette affection pour permettre des diagnostics précoces et des interventions thérapeutiques avant l’installation de lésions tissulaires définitives.
La réponse initiale au traitement constitue un indicateur pronostique dynamique particulièrement informatif. L’amélioration clinique et paraclinique dans les 4-6 premières semaines de traitement corrèle généralement avec un pronostic favorable à moyen et long terme. À l’inverse, l’absence d’amélioration notable après 8 semaines de traitement bien conduit suggère un pronostic plus réservé, nécessitant généralement une réévaluation diagnostique complète et une modification substantielle de l’approche thérapeutique.
Les caractéristiques intrinsèques du parasite, notamment sa sensibilité aux agents thérapeutiques disponibles, influencent également le pronostic. Certaines souches de Leishmania infantum présentent des résistances aux molécules classiquement utilisées (particulièrement documentées pour l’antimoniate de méglumine dans certaines régions méditerranéennes), compliquant significativement la gestion thérapeutique et assombrissant le pronostic à long terme.
Conclusion
La leishmaniose féline, longtemps considérée comme anecdotique, s’affirme aujourd’hui comme une entité clinique dont la prévalence et l’importance diagnostique progressent constamment, particulièrement dans les régions méditerranéennes et dans un contexte d’expansion géographique liée aux modifications climatiques. Cette parasitose complexe présente chez le chat des caractéristiques épidémiologiques, cliniques et thérapeutiques partiellement distinctes de son homologue canine, justifiant une approche spécifiquement adaptée à l’espèce féline.
Le polymorphisme clinique remarquable de cette affection, dominé par des manifestations cutanées mais pouvant s’étendre à diverses présentations viscérales, impose une vigilance diagnostique soutenue et une démarche méthodique combinant évaluations cliniques, paracliniques et tests spécifiques. L’influence déterminante du statut immunitaire sur l’expression clinique et l’évolution de l’infection souligne l’importance d’une approche holistique de ces patients.
Les avancées diagnostiques récentes, notamment l’optimisation des techniques sérologiques et moléculaires pour l’espèce féline, contribuent progressivement à améliorer la détection des cas cliniques et subcliniques. Parallèlement, les approches thérapeutiques, bien qu’encore largement extrapolées des protocoles canins, démontrent une efficacité satisfaisante, particulièrement pour les formes cutanées traitées précocement.
La prévention, élément fondamental de la gestion sanitaire de cette zoonose, doit intégrer les particularités comportementales félines dans une stratégie combinant protection individuelle contre les phlébotomes et mesures environnementales limitant la prolifération vectorielle. Le rôle épidémiologique exact du chat dans le cycle de transmission de Leishmania infantum demeure partiellement élucidé, mais les données récentes suggèrent une contribution potentiellement significative dans certains contextes écologiques spécifiques.
Les perspectives futures incluent nécessairement la standardisation de protocoles diagnostiques et thérapeutiques spécifiquement validés pour l’espèce féline, le développement d’options préventives adaptées, et l’approfondissement des connaissances sur les interactions complexes entre ce parasite et l’immunité féline.
La sensibilisation des praticiens vétérinaires à cette affection émergente, l’inclusion systématique de la leishmaniose dans les diagnostics différentiels des dermatoses nodulaires ou ulcératives félines en zone d’endémie, et la mise en œuvre d’approches diagnostiques et thérapeutiques précoces constitueront les clés d’une gestion optimale de cette parasitose chez le chat.
