L’article présente le développement et la validation du PAX (Pet Allergy Xplorer), ce test sérologique innovant multiplex par macroarray qui détecte les IgE spécifiques aux allergènes chez les animaux.
La détection des sensibilisations IgE chez les chiens allergiques est généralement réalisée à l’aide d’extraits d’allergènes, mais ceux-ci sont difficiles à standardiser. Le PAX a été conçu en réponse à cette problématique, en utilisant à la fois des extraits d’allergènes et des composants moléculaires uniques pour identifier les sensibilisations. Nous vous proposons de découvrir une série de bulletins pour comprendre tous les détails de cet article.
Dans ce quatrième bulletin, nous nous penchons sur différentes étapes de validations du test PAX : précision, reproductibilité, cohérence et performances.
4ème : Validation de la précision du test, de la cohérence des résultats attendus, des performances et de l’influence des biais potentiels.
-
Validation de la précision du test
L’étude détaille l’évaluation de la précision du test PAX et des coefficients de variation (CV%) ont été calculés.
Les résultats montrent une reproductibilité comparable aux dosages ELISA des IgE spécifiques d’allergènes pour chiens [38, 39], démontrant une précision stable tant en laboratoire qu’en conditions prolongées sur un an d’utilisation.
-
Validation de la cohérence des résultats attendus
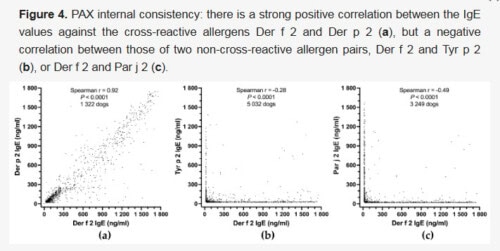
L’évaluation de la cohérence des résultats attendus a été réalisée en étudiant la corrélation des résultats entre allergènes connus pour leur réactivité croisée ou au contraire leur absence de réactivité croisée.
En 2023, sur 23 858 chiens européens suspectés d’allergie, des sérums positifs à Der f 2 ou Der p 2 (≥ 28 ng/mL) ont été sélectionnés. Ces allergènes, provenant d’espèces d’acariens étroitement apparentées, présentent une forte réactivité croisée (coefficient A-RISC de 0,91 [25]). Le coefficient de corrélation de Spearman entre leurs taux d’IgE était élevé (r = 0,92 ; p < 0,0001), indiquant une forte corrélation (figure a).
En revanche, la corrélation entre Der f 2 et Tyr p 2, appartenant à la même famille de NPC2 [25] mais avec une faible réactivité croisée connue, était significative mais négative (r = -0,28 ; p < 0,0001, figure b), suggérant généralement une sensibilisation à l’un ou l’autre uniquement. Une corrélation négative encore plus forte a été observée entre Der f 2 et Par j 2, une protéine provenant d’une plante (Parietaria judaica) non apparentée (r = -0,49 ; p < 0,0001, figure c), confirmant l’absence de réactivité croisée entre ces sources d’allergènes distinctes.
Ces résultats démontrent l’excellente cohérence des résultats attendus du PAX, capable d’identifier les corrélations positives entre allergènes apparentés tout en détectant peu de positivité simultanée entre allergènes non apparentés. Ces résultats concordent parfaitement avec la prédiction théorique de réactivité croisée entre ces allergènes [25].
Cela valide la fiabilité du test dans la détection des sensibilisations spécifiques aux allergènes chez les chiens.
-
Caractéristiques de performance du test
L’évaluation des performances du test PAX chez les chiens a été réalisée en analysant sa sensibilité, sa spécificité, sa précision et ses valeurs prédictives. La sensibilité et la spécificité d’un test de sensibilisation aux IgE sont difficiles à mesurer en raison de la présence d’IgE non pathogènes chez les chiens sains et allergiques. De plus, il est compliqué de lier les poussées allergiques à des allergènes environnementaux spécifiques.
Pour déterminer la précision du PAX, des sérums de deux groupes de chiens de laboratoire ont été analysés.
Le groupe allergique comprenait 31 chiens sensibilisés expérimentalement aux acariens Der f, ayant présenté des réactions cliniques après application de cet allergène, tandis que le groupe contrôle comportait 83 beagles non sensibilisés, jugés sains. Les chiens étaient considérés comme positifs si leurs taux d’IgE atteignaient 28 ng/mL ou plus. Les résultats ont montré que 27 des 31 chiens allergiques avaient un test positif, tandis que 81 des 83 chiens sains avaient un test négatif.
Statut de sensibilisation aux acariens de la poussière de maison.
Les paramètres de performance du PAX calculés étaient les suivants :
- Sensibilité : 87,1 % ;
- Spécificité : 97,6 % ;
- Précision globale : 94,7 % ;
- Valeur prédictive positive : 93,1 % ;
- Valeur prédictive négative : 95,3 %.
En somme, le PAX démontre une fiabilité remarquable dans la détection des sensibilisations cliniquement pertinentes chez les chiens.
-
Influence des biais potentiels
L’étude a évalué l’influence de plusieurs facteurs de biais potentiels sur les performances du test PAX. Les analyses ont porté sur l’effet du type d’échantillon, de la température de stockage des sérums et des interférences biochimiques telles que l’hémolyse, la lipémie et l’ictère.
Effet du type d’échantillon
Pour déterminer s’il serait acceptable de soumettre des échantillons de plasma au lieu de sérum (le type standard pour la sérologie des IgE), du sang prélevé sur quatre chiens atopiques a été réparti entre des tubes secs (pour le sérum) et des tubes contenant du citrate, de l’héparine et de l’EDTA. Les résultats ont montré que certaines valeurs faiblement positives dans le sérum sont devenues négatives avec le plasma.
Taux de récupération moyens (intervalle de confiance à 95 %) et coefficients de variation (CV %).
Ces résultats indiquent que l’utilisation de sérum est préférable pour garantir la fiabilité des résultats.
Effet de la température de stockage
Cinq sérums ont été prélevés et testés à J0, J3, J7, J14, J21 et J28.
A J0, 32 résultats positifs d’IgE spécifiques à l’allergène ont été obtenus.
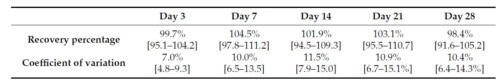
Les sérums ont ensuite été stockés à température ambiante (environ 22 °C) et à 37 °C pendant 28 jours pour simuler un transport prolongé.
Les valeurs sIgE sont restées stables à température ambiante, bien que des baisses aient été observées pour un des chiens à J3, entraînant la perte de positivité pour une valeur à J21.
Néanmoins, dans l’ensemble, les tests répétés (six fois sur 28 jours) des cinq sérums conservés à température ambiante n’ont pas donné de résultats significativement différents (ANOVA à mesures répétées à une voie ; p = 0,1436). Quel que soit le jour de test, les valeurs d’IgE n’étaient significativement pas différentes de celles du jour 0.
Taux de récupération moyens (intervalle de confiance à 95 %) et coefficients de variation (CV %) des sérums conservés à température ambiante (environ +22 °C) pendant 28 jours.
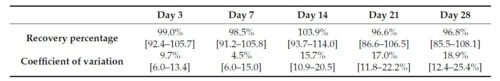
À 37 °C, les valeurs d’IgE n’ont pas beaucoup changé pour 2 des 5 chiens. Pour les 3 autres, plusieurs valeurs sIgE avaient diminué à J28 de 30 à 60% des valeurs initiales, avec l’une des 32 valeurs IgE s’étant négativée. Les valeurs de sIgE n’étaient pas significativement différentes au cours des 28 jours de test (ANOVA à mesures répétées à une voie ; p = 0,099).
Taux de récupération moyens (intervalle de confiance à 95 %) et coefficients de variation (CV %) des sérums conservés à 37°C pendant 28 jours
Ces observations suggèrent que les niveaux de sIgE restent relativement stables dans le temps, cependant plus les sérums sont conservés à des températures élevées, plus la variabilité des résultats du PAX est élevée. Ces résultats sont cohérents avec les rapports récents sur les sérums testés par ELISA et conservés à des températures élevées [41,42]. Par conséquent, il est conseillé de veiller à expédier les échantillons dans un délai inférieur à deux semaines, particulièrement en période estivale ou dans les régions chaudes.
Effet de l’hémolyse, de la lipémie et de l’ictère
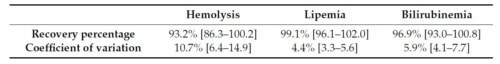
Nous avons ensuite voulu évaluer l’effet de l’hémolyse, de la lipémie et de l’ictère sur les valeurs d’IgE obtenues avec le PAX. Le sérum d’un chien présentant 26 IgE spécifiques positives a été testé avec de l’hémoglobine, des triglycérides ou de la bilirubine, à des valeurs correspondant au sérum d’un chien présentant une anémie hémolytique visible, une hyperlipidémie ou un ictère, respectivement.
Les résultats ont montré des taux de récupération proches des valeurs initiales, mais l’ajout d’hémoglobine a entraîné la négativation de 3 valeurs faiblement positives. Bien que ces interférences n’aient pas généré de différences statistiquement significatives, les résultats suggèrent qu’une hémolyse importante peut fausser la détection des faibles concentrations d’IgE.
Taux de récupération moyens (intervalle de confiance à 95 %) et coefficients de variation (CV %).
Conclusions
Les résultats démontrent que le type d’échantillon, la durée et la température de stockage, ainsi que certaines interférences biochimiques peuvent influencer les performances du PAX. Le plasma, surtout avec citrate, peut sous-estimer les niveaux d’IgE, et une température élevée de stockage pendant plus de deux semaines peut augmenter la variabilité des résultats. Bien que l’hémolyse, la lipémie et l’ictère n’affectent pas significativement les valeurs sIgE dans la majorité des cas, une hémolyse sévère peut induire des résultats faussement négatifs pour les échantillons avec des taux d’IgE proches du seuil de positivité. Il est donc recommandé d’utiliser exclusivement du sérum et de limiter la durée de transport, en particulier lors de conditions chaudes, pour garantir la précision des résultats du PAX.
Découvrez la fin de l’analyse de cette publication dans notre prochain article !
Et pour lire l’article original dans son intégralité, cliquez ici : https://www.mdpi.com/2306-7381/11/10/482
Pour toute question, contact-france@nextmune.com
Références
[25] Chruszcz, M.; Kapingidza, A.B.; Dolamore, C.; Kowal, K. A robust method for the estimation and visualization of IgE cross-reactivity likelihood between allergens belonging to the same protein family. PLoS ONE 2018, 13, e0208276.
[38] Okayama, T.; Matsuno, Y.; Yasuda, N.; Tsukui, T.; Suzuta, Y.; Koyanagi, M.; Sakaguchi, M.; Ishii, Y.; Olivry, T.; Masuda, K. Establishment of a quantitative ELISA for the measurement of allergen-specific IgE in dogs using anti-IgE antibody cross-reactive to mouse and dog IgE. Vet. Immunol. Immunopathol. 2011, 139, 99–106.
[39] Lee, K.W.; Blankenship, K.D.; McCurry, Z.M.; Esch, R.E.; DeBoer, D.J.; Marsella, R. Performance characteristics of a monoclonal antibody cocktail-based ELISA for detection of allergen-specific IgE in dogs and comparison with a high affinity IgE receptor-based ELISA. Vet. Dermatol. 2009, 20, 157–164.
[41] Christian, M.; Wagner, R.; Kahnt, E. Pilot study on the storage stability of allergen- specific immunoglobulin (Ig)E against house dust and storage mites in serum of dogs (abstract). Vet. Dermatol. 2024, 35, 105.
[42] Christian, M.; Wagner, R.; Müller, E. Storage stability of allergen-specific immunoglobulin E against house dust and storage mites in sera of dogs with a focus on warm temperature and exposure to sunlight (abstract). Vet. Dermatol. 2024, 35, 50.