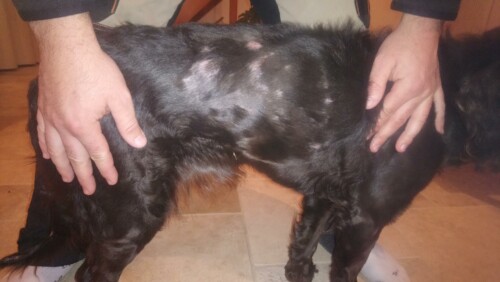
Un chien d’Oysel Allemand femelle de 2,5 ans est présentée en consultation spécialisée pour des lésions cutanées évoluant depuis 6 mois, ne répondant pas à un traitement antibiotique (céfalexine, dose non renseignée).
Thomas Brément
DMV, Dip.ECVD , Vet’Dermathome, Clinique Vétérinaire TouraineVet
Avril 2024
Commémoratif/Anamnèse
Les lésions sont apparues initialement sur les membres postérieurs, les coussinets et la queue, puis plus tardivement sur la face (chanfrein). La chienne vit en milieu boisé avec accès libre à l’extérieur, mange une alimentation sèche de grande surface en libre-service et est par ailleurs irrégulièrement traitée contre les parasites externes avec une spécialité de fluralaner et vermifugée deux fois par an (molécule non renseignée).
Examen clinique et diagnostic différentiel
L’examen clinique ne révèle aucune atteinte générale. Une augmentation modérée de la prise de boisson est rapportée et une hyperlaxité ligamentaire des quatre membres, responsable d’un défaut d’aplomb est notée, ainsi qu’une hyper-extensibilité et hyperfragilité cutanée, confirmée par un historique de nombreuses « blessures » longues à cicatriser selon les propriétaires. Le bilan de l’examen dermatologique est une dermatose chronique récidivante intensément et secondairement prurigineuse multifocale intéressant le bout de la queue, les coussinets, les doigts et le chanfrein caractérisée par des lésions érythémateuses, ulcérées, suintantes et croûteuses, de rares furoncles et nodules.
Le diagnostic différentiel inclut en priorité une pyodermite bactérienne ou une mycose profonde, un syndrome (pyo)granulome stérile, une démodécie ou une néoplasie, associée à un syndrome d’Ehlers-Danlos (de type dermatosparaxis) ou une dysendocrinie (hypothyroïdie, hypercorticisme).
Examens complémentaires et diagnostic
Aucun élément figuré n’est observé aux raclages cutanés. La cytologie cutanée montre la présence de nombreux polynucléaires neutrophiles majoritairement dégénérés et macrophages, de rares éosinophiles et lymphocytes, de nombreuses bactéries de type cocci en position extra et intracellulaire (images de phagocytose), confirmant la présence d’une infection bactérienne profonde. L’index d’extensibilité cutané est de 15,6%, soit supérieur à 14.5%, en faveur d’un syndrome d’hyperextensibilité/hyperfragilité cutané [1].
Une mesure de la T4 totale et de la TSH canine sont effectuées et dans les valeurs usuelles, écartant l’hypothèse d’une hypothyroïdie. Un test de stimulation à l’ACTH est réalisé et ne montre pas d’anomalie, rendant l’hypothèse d’un hypercorticisme peu probable dans ce contexte clinique.
Traitement et suivi
Une nouvelle antibiothérapie à base de doxycycline (10mg/kg par jour), une supplémentation par voie orale en vitamine C (20mg/kg BID) et en acides gras essentiels et un traitement antiparasitaire mensuel à base d’afoxolaner sont mis en place. En parallèle, des mesures hygiéniques (coupe de griffes régulière, coussin à mémoire de forme pour les lieux de couchage, port d’un manteau protecteur incluant de préférence les membres pour les sorties, éviction de la chasse, port de bottines…) sont instaurées dans le but de prévenir autant que possible les traumatismes extérieurs.
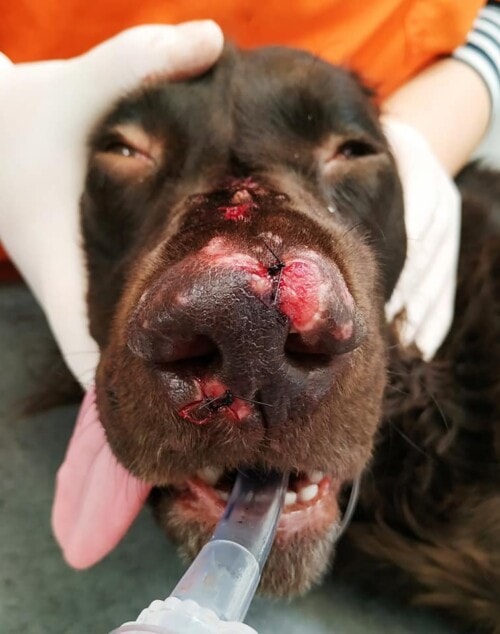
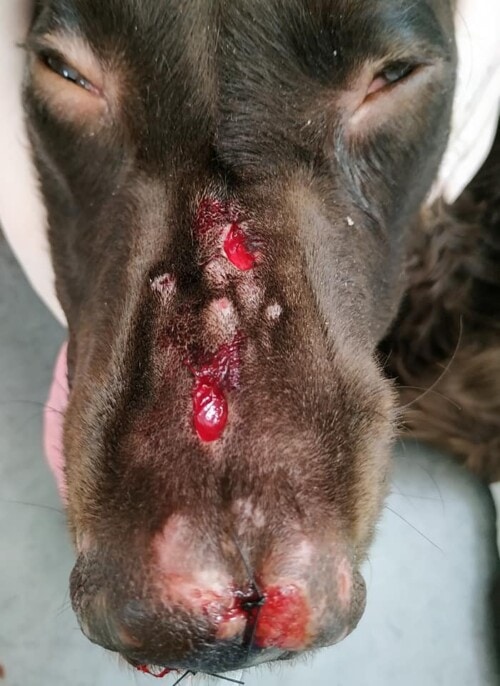
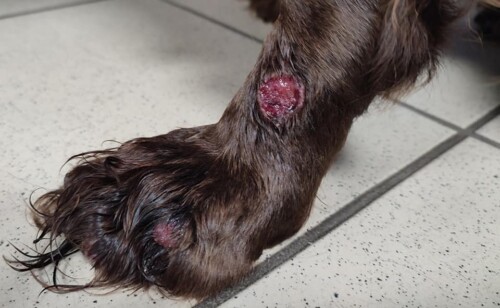
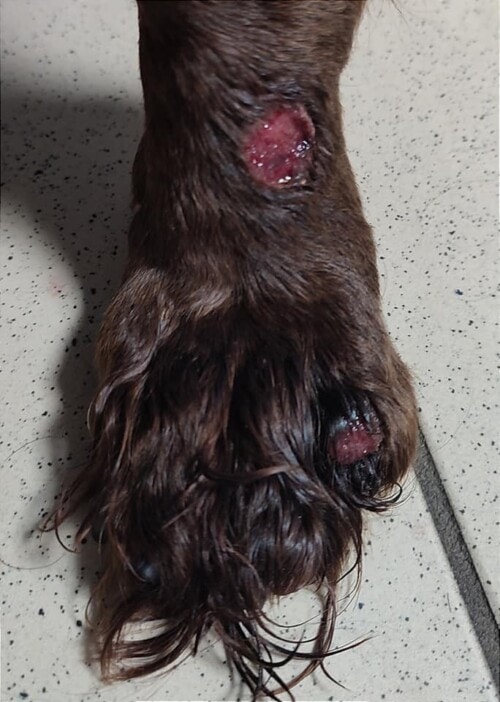
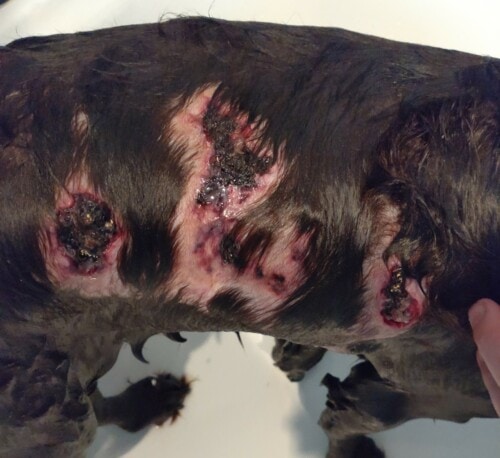
Aucune amélioration clinique n’est notée après un mois (photos 1 à 4). La cytologie révèle une réaction pyogranulomateuse sans bactéries. Des biopsies sont réalisées pour une analyse histopathologique et une culture fongique.
Photos 1 à 4 : état clinique lors de la deuxième consultation : notez la présence de lésions nodulaires et ulcérées sur la face et les membres.
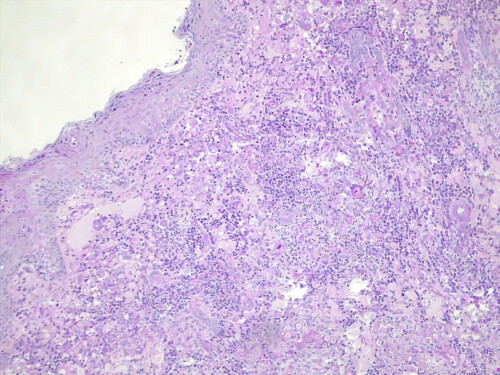
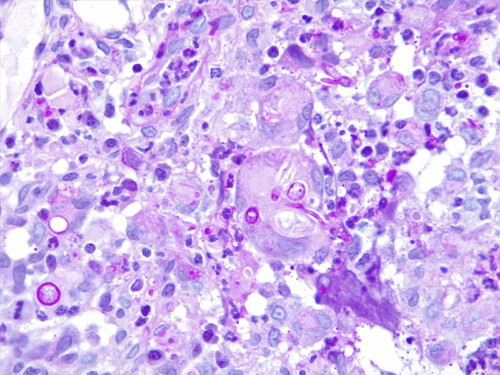
Cette dernière est négative mais l’analyse histopathologique, examinée en coloration standard et APS, montre des lésions nodulaires, isolées ou parfois coalescentes siégeant dans le derme et s’étendant jusque dans l’hypoderme, formées d’une plage dense de cellules macrophagiques dont le cytoplasme apparaît granuleux, basophile. Ces foyers granulomateux sont centrés par plusieurs éléments basophiles constitués d’un cément bleuté, parsemé d’éléments fongiques, ovoïdes, mais également filamenteux, réfringents. Aucun élément fongique n’est mis en évidence au sein des annexes cutanées, mais certains granulomes sont en rapport ou à proximité directe de follicules pileux (photos 5 et 6).
Photos 5 et 6 : aspect histopathologique des lésions : notez la présence de lésions nodulaires, isolées ou parfois coalescentes siégeant dans le derme et s’étendant jusque dans l’hypoderme (photo 5) et de foyers granulomateux centrés par des éléments fongiques, ovoïdes et filamenteux ramifiés (hyphes) (photo 6).
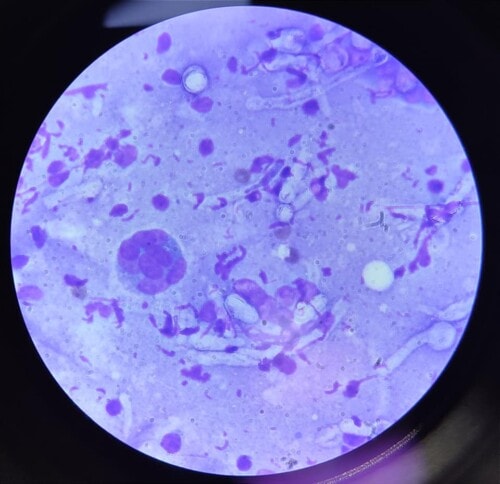
Un traitement antifongique systémique à base de kétoconazole (8mg/kg par jour) associé à un traitement topique d’une solution d’enilconazole diluée au 50ème à raison d’une application tous les 3 jours pendant 6 semaines est mis en place. Après 1 mois de traitement, une nette amélioration clinique sans guérison complète est rapportée (contact téléphonique) puis, la chienne est perdue de vue pendant 4 mois avant d’être de nouveau présentée en consultation pour une récidive. La cytologie montre la présence de polynucléaires neutrophiles majoritairement dégénérés, de macrophages géants multinucléés et de très nombreuses structures fongiques (hyphes, spores… photo 7).
Photo 7 : aspect cytologique des lésions : notez la présence d’hyphes septés et ramifiés non pigmentés et de cellules géantes multinucléées (macrophages).
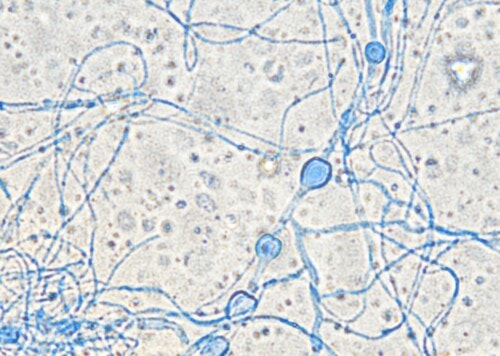
Des biopsies cutanées sont de nouveau réalisées pour une deuxième tentative de culture fongique sur milieux SC et SCA à 27°C et 37°C, révélant, sur milieu SC à 27°C uniquement, la présence de nombreuses colonies d’un champignon filamenteux non identifié (photo 8).
Photo 8 : examen microscopique d’un calque coloré obtenu à partir du prélèvement reçu par le laboratoire de mycologie : notez la présence de nombreuses colonies d’un champignon filamenteux à ce stade non identifié
Un séquençage PCR conduit finalement à l’identification d’un champignon du genre Penicillium de la section Ramosum et plus particulièrement d’un représentant du groupe Raistrickiorum. Le traitement à base de kétoconazole est repris mais est associé à une mauvaise tolérance (vomissements et abattement) et ne permet pas d’amélioration clinique après 1 mois de prise en charge. Il est alors remplacé par un traitement à base d’itraconazole (5mg/kg/j), permettant une résolution des lésions en 3 mois (photos 9 et 10). Un mois plus tard, suite à une fugue dans la forêt, de nouvelles lésions sévèrement ulcératives et nécrotiques se sont rapidement développées sans évolution favorable (photo 11), menant à l’euthanasie de la patiente 3 mois après la fin du traitement à base d’itraconazole. L’autopsie a été proposée mais refusée par les propriétaires.
Photos 9 et 10 : état clinique 3 mois après l’initiation du traitement à base d’itraconazole. Notez la guérison clinique des lésions avec la persistance de zones cicatricielles sur la face et le tronc.
Photo 11 : Dégradation sévère de l’état cutané avec l’apparition de lésions ulcérées et nécrotiques, justifiant l’euthanasie du patient.
Discussion
Les Penicillium sont des agents de moisissure saprophytes, provenant de l’environnement, majoritairement présents dans le sol ou l’eau. Leur implication clinique réelle lors de dermatomycose et la pathogénie de ces infections restent pour autant très peu étudiées. Une ancienne étude a démontré la présence de Penicillium sp dans des lésions cutanées superficielles chez des chiens avec une prévalence faible ; 2.4% de 205 lésions cutanées prélevées, sans qu’il soit pour autant possible de déterminer avec certitude que le champignon soit la cause des lésions [2].
Ces organismes sont également rarement impliqués dans des cas d’infections sous-cutanées opportunistes par des champignons non pigmentés (hyalohyphomycose) [3]. L’infection fait probablement suite à une inoculation via un traumatisme cutané ou à une invasion via les muqueuses, notamment du tractus respiratoire [3].
Chez l’homme, de rares cas d’infection à Penicillium sont décrits, impliquant des infections pulmonaires, oculaires, du système circulatoire (endocardite, fongémie), péritonite et des cas isolés d’infection cérébrale, paravertébrale, urinaire ou oesophagite [4].
L’analyse bibliographique montre qu’aucun cas clinique (humain ou animal) correspondant à l’infection par le type de Penicillium identifié dans ce cas n’a été rapporté. Ce cas fait partie d’une série de quatre, associée à une revue de la littérature publiée très récemment [5], décrivant pour la première fois en France une infection à Penicillium chez le chien. Seuls sept autres cas de pénicilliose ont été décrits en médecine vétérinaire chez le chien depuis 1990, impliquant une infection disséminée pour deux d’entre eux et une forme localisée chez les cinq autres (2 infections pulmonaires et 3 atteintes osseuses) [5]. Ce cas est le premier cas avéré de dermatomycose sans signe clinique d’infection systémique disséminée à Penicillium décrit chez le chien.
Dans les cas décrits ci-dessus, le pronostic était bon avec une rémission obtenue chez 6 d’entre-eux suite à la mise en place d’un traitement antifongique incluant majoritairement l’utilisation de l’itraconazole éventuellement couplée à des combinaisons diverses de dérivés azolés (kétoconazole, fluconazole, voriconale), amphotécine B et terbinafine [5], voire une exérèse chirurgicale lors d’infection localisée. Dans notre cas, l’itraconazole a permis une guérison clinique et cytologique des lésions infectieuses fongiques.
Trop souvent, le développement d’infections à germes qualifiés d’opportuniste est associé à un état immunodéprimé. Cependant, à l’exception de deux cas pour lesquels une corticothérapie longue a été rapportée, aucune autre affection débilitante n’a pu être identifiée. Aucune race n’est nettement prédisposée bien que le Berger Allemand soit régulièrement impliqué dans des cas de hyalohyphomycose [3]. Dans notre cas, le seul facteur favorisant est la présence d’un syndrome d’hyperextensibilité/fragilité cutané (ou syndrome d’Ehlers-Danlos) et un contexte de vie en milieu boisé, favorisant l’inoculation d’agents pathogènes opportunistes. Chez l’homme, certains sous-types de syndrome d’Ehlers-Danlos ont été associés à des infections sous-cutanées récurrentes [6].
En conclusion, bien que rare, une infection opportuniste à Penicillium doit être envisagée en cas de suspicion de mycose sous-cutanée chez le chien. Afin de réduire le risque de mettre en culture une souche purement contaminante, sans rôle pathogène, le prélèvement pour une culture doit se faire par biopsie et envoi des couches profondes de l’échantillon prélevé, en condition d’asepsie de surface rigoureuse. En cas de culture négative ou au résultat atypique, le recours à la biologie moléculaire peut préciser l’agent pathogène en cause, le diagnostic et le pronostic et permettre d’optimiser la suite de la démarche de recherche clinique (infection disséminée etc…).
Remerciements : Merci à l’équipe de recherche 3142 du CHU d’Angers (Pr Jacques Guillot) pour l’analyse PCR réalisée pour l’identification de l’agent pathogène décrit dans ce cas.
Références bibliographiques
[1] FREEMAN (LJ) et coll., « Ehlers-Danlos syndrome in dogs and cats », Semin Vet Med Surg, n°2, 1987, pages 221-227, 1987
[2] JAND (SK) et coll., « Dermatomycosis in dogs », Mycoses, n°32(2), 1988, pages 104-105
[3] MILLER (WH), GRIFFIN (CE), CAMPBELL (KL), « Muller and kirk’s Small Animal Dermatology, Chapitre Fungal and algal skin diseases – Hyalohyphmycosis », 2013, pages 255
[4] LYRATZOPOULOS (G) et coll., « Invasive infection due to penicillium species other than P. marneffei », J Infect., n°45(3), 2002, pages 184–95
[5] MONTPIERRE (L) et coll., « Penicillium and Talaromyces spp. emerging pathogens in dogs since 1990s », Medical Mycology, n° 61 (9), 2023, pages ….
[6] BRADY (AF) et coll., « The Ehlers–Danlos Syndromes, Rare Types », American Journal of Medical Genetics Part C (Seminars in Medical Genetics), n°175C, 2017, pages 70–115.
Crédits photos :
– Photos cliniques et cytologiques : Thomas Brément
– Photos histopathologiques : LAPVSO
– Photos de la mycologie : Jacques Guillot