La pododermatite plasmocytaire est une dermatose féline rare et mal comprise, mais qui ne doit pas être négligée en consultation, notamment du fait de la douleur et donc de la boiterie qu’elle peut occasionner. Tour d’horizon sur les dernières connaissances, tant en termes d’étiopathogénie, que du diagnostic et des derniers traitements et protocoles publiés.
William BORDEAU, DVM
Cabinet VetDerm, Maisons Alfort (94)
Février 2026
Introduction et cadre nosologique
1.1. Définition et dénomination
La pododermatite plasmocytaire féline (PPF) constitue une dermatose inflammatoire rare, caractérisée par une infiltration massive de plasmocytes matures dans le derme des coussinets du chat. Cette entité, familièrement désignée sous le terme anglophone de pillow foot en raison de l’aspect tumescent et mou des coussinets atteints, occupe une place singulière dans le paysage dermatologique vétérinaire (Miller 2013). La maladie se distingue par son tropisme exclusif pour le tissu podal, sans équivalent exact chez le chien ou chez l’homme, bien que des parallèles physiopathologiques puissent être établis avec certaines proliférations plasmocytaires cutanées humaines. Sur le plan nosologique, la PPF appartient au groupe des dermatoses plasmocytaires félines, un spectre qui inclut la stomatite plasmocytaire chronique et, de manière plus controversée, certaines formes de dermatite plasmocytaire extra-podale (Gross 2005). L’infiltrat est composé à plus de 90 % de plasmocytes bien différenciés exprimant le marqueur CD138 (syndecan-1), ce qui la distingue formellement des néoplasies plasmocytaires telles que le plasmocytome extramédullaire, où l’indice de prolifération Ki-67 dépasse habituellement 20 % (Mauldin 2016).
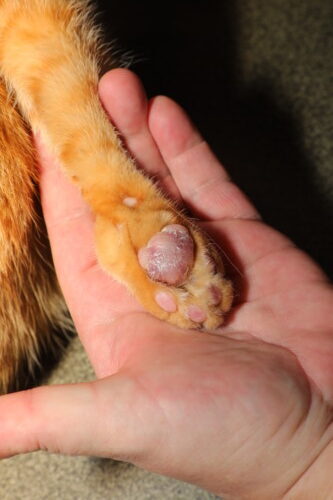
Aspect classique d’une pododermatite plasmocytaire féline
1.2. Jalons historiques et évolution des connaissances
Les premières descriptions clinicopathologiques de la PPF remontent à la fin des années 1970, lorsque Gruffydd-Jones, Orr et Lucke publient en 1980 une série de cinq chats présentant un gonflement et une ulcération des coussinets associés à une infiltration plasmocytaire dermique dense (Gruffydd-Jones 1980). Cette publication fondatrice établit les critères morphologiques de base qui guident encore la reconnaissance de l’affection. Au cours de la décennie suivante, Taylor et Schmeitzel rapportent en 1990 deux cas compliqués d’hémorragies chroniques au niveau des coussinets, soulignant le potentiel évolutif de la maladie vers l’ulcération profonde et la fragilisation vasculaire (Taylor 1990). L’avènement des tests sérologiques pour le virus de l’immunodéficience féline (FIV) dans les années 1990 a permis de mettre en lumière une association statistique entre rétroviroses et PPF, un lien exploré dans plusieurs séries rétrospectives montrant une séroprévalence FIV allant de 20 à 62 % chez les chats atteints, contre 2 à 4 % dans la population féline générale (Guaguère 2004 ; Dias Pereira 2003). L’étude rétrospective de Guaguère et collaborateurs, portant sur 26 cas, constitue à ce jour l’une des plus larges cohortes publiées et a contribué à affiner la compréhension du profil épidémiologique et de la réponse thérapeutique (Guaguère 2004). L’introduction de la doxycycline comme traitement de première intention, au début des années 2000, a représenté un tournant thérapeutique, offrant une alternative à la corticothérapie au long cours avec un taux de réponse complète avoisinant 50 à 65 % selon les séries (Bettenay 2003).
Épidémiologie
2.1. Prévalence et données d’incidence
La PPF demeure une affection peu fréquente dont la prévalence exacte reste difficile à établir, en partie du fait d’un sous-diagnostic probable lié à la résolution spontanée de certaines formes bénignes. Les données disponibles, issues de centres de référence en dermatologie vétérinaire, situent sa fréquence entre 0,5 et 1,5 % de l’ensemble des consultations dermatologiques félines (Miller 2013). Dans la série de Dias Pereira et Faustino, analysant 8 cas diagnostiqués sur une période de sept ans dans un centre universitaire portugais, l’incidence annuelle est estimée à environ 1,1 cas pour 1 000 consultations félines (Dias Pereira 2003). Cette rareté relative n’exclut pas une prévalence sous-estimée en pratique courante, dans la mesure où les stades précoces non ulcérés passent fréquemment inaperçus. Aucune variation géographique significative n’a été rapportée, les cas étant documentés sur tous les continents, de l’Europe à l’Amérique du Nord, en passant par l’Asie et l’Australie (Hnilica 2017). Le caractère sporadique de la maladie, sans phénomène de clustering temporel ou spatial, plaide contre une étiologie infectieuse transmissible directe et oriente davantage vers une pathogénie dysimmunitaire individuelle.
2.2. Facteurs de risque démographiques : race, âge et sexe
Contrairement à de nombreuses dermatoses félines pour lesquelles un déterminisme génétique a été identifié — par exemple le gène PNPLA1 dans l’ichthyose du Golden Retriever ou le gène KRT10 dans l’ichthyose épidermolytique —, aucune prédisposition raciale claire n’a été démontrée pour la PPF (Miller 2013). La majorité des cas rapportés concerne des chats de type européen à poil court, ce qui reflète la prédominance de cette population dans les consultations vétérinaires plutôt qu’une susceptibilité génétique spécifique. La cohorte de Guaguère incluait 23 chats européens sur 26 (88,5 %), les trois restants étant respectivement un Persan, un Siamois et un Chartreux (Guaguère 2004). L’analyse de la série de Dias Pereira confirme cette absence de prédisposition raciale, avec une distribution proportionnelle à la population de référence (Dias Pereira 2003).
L’âge au moment du diagnostic varie considérablement, allant de 6 mois à 14 ans, avec une médiane se situant entre 4 et 7 ans selon les études (Gross 2005 ; Guaguère 2004). Cette large fourchette d’âge suggère que la maladie ne correspond ni à une affection juvénile de développement, ni à une pathologie strictement gériatrique, mais qu’elle peut survenir à tout moment de la vie adulte en fonction de la convergence de facteurs immunologiques individuels. En ce qui concerne le sexe, les données restent contradictoires. Certaines séries rapportent une légère prédominance pour les mâles avec un sex-ratio de 1,4:1 en faveur des mâles (Guaguère 2004), tandis que d’autres ne retrouvent aucune différence significative. Le statut reproducteur (entier ou stérilisé) ne semble pas exercer d’influence déterminante, bien que la plupart des chats inclus dans les études publiées soient stérilisés, conformément aux pratiques de gestion de population féline domestique en vigueur dans les pays industrialisés. L’absence d’un polymorphisme génétique identifié associé à la PPF contraste avec d’autres dermatoses immunitaires félines, comme le complexe granulome éosinophilique où des facteurs génétiques polygéniques ont été suspectés, et renforce l’hypothèse d’une pathogénie acquise impliquant des cofacteurs environnementaux ou infectieux.
Étiopathogénie : une dysrégulation immunitaire multifactorielle
3.1. Arguments en faveur d’une origine dysimmunitaire
L’étiologie de la PPF reste à ce jour incomplètement élucidée, mais l’ensemble des données cliniques, biologiques et histopathologiques convergent vers une pathogénie à médiation immune. Plusieurs arguments soutiennent cette hypothèse. Le premier repose sur la nature même de l’infiltrat, composé quasi exclusivement de plasmocytes matures polyclonaux, indicateurs d’une activation antigénique chronique et soutenue du compartiment lymphocytaire B. L’analyse immunohistochimique révèle que ces plasmocytes expriment à la fois les chaînes légères kappa et lambda des immunoglobulines dans un ratio physiologique d’environ 2:1, excluant un processus monoclonal néoplasique (Gross 2005 ; Mauldin 2016). Le deuxième argument découle de l’hypergammaglobulinémie polyclonale documentée chez 50 à 63 % des chats atteints, témoignant d’une stimulation diffuse du système immunitaire humoral, sans spécificité antigénique identifiée (Guaguère 2004). L’électrophorèse des protéines sériques met en évidence une élévation des fractions gamma sans pic monoclonal, distinguant formellement cette condition d’un myélome multiple ou d’un plasmocytome sécrétant. Enfin, la réponse favorable à des agents immunomodulateurs ou immunosuppresseurs — doxycycline, glucocorticoïdes, ciclosporine — constitue un argument thérapeutique indirect en faveur d’un mécanisme dysimmunitaire (Bettenay 2003 ; Miller 2013).
La détection d’anticorps antinucléaires (ANA) chez une proportion non négligeable de chats atteints, estimée entre 25 et 50 % selon les séries, renforce l’hypothèse auto-immune, bien que la signification clinique de ces ANA reste débattue en médecine féline (Dias Pereira 2003). Leur présence pourrait refléter une activation lymphocytaire non spécifique plutôt qu’une véritable réactivité autodirigée. L’analyse par immunofluorescence directe des biopsies de coussinets a démontré des dépôts d’IgG, d’IgM et de fraction C3 du complément à la jonction dermo-épidermique et autour des vaisseaux dermiques chez une majorité de cas, un patron évocateur d’une maladie à complexes immuns (Gross 2005). Ces dépôts rappellent ceux observés dans le lupus érythémateux systémique félin, suggérant un mécanisme physiopathologique partiellement partagé impliquant la voie classique du complément déclenchée par la fixation du fragment C1q aux complexes antigène-anticorps.
3.2. Implication du virus de l’immunodéficience féline et des rétrovirus
L’association entre PPF et infection par le FIV constitue l’un des aspects les plus discutés de l’étiopathogénie. Plusieurs études rétrospectives rapportent une séroprévalence FIV significativement plus élevée chez les chats atteints de PPF que dans la population générale. Dans la série de Guaguère, 50 % des 26 chats testés étaient séropositifs pour le FIV, un taux nettement supérieur à la prévalence attendue de 2 à 4 % dans la population féline domestique européenne (Guaguère 2004). Dias Pereira et Faustino retrouvent une séroprévalence de 62,5 % dans leur cohorte de 8 cas (Dias Pereira 2003). Le FIV, un lentivirus de la famille des Retroviridae, provoque une dérégulation profonde de l’immunité adaptative par déplétion progressive des lymphocytes T CD4+ et par activation polyclonale chronique des lymphocytes B. Ce phénomène, médié par la stimulation directe du récepteur Toll-like 7 (TLR7) par l’ARN viral simple brin et par la sécrétion aberrante d’IL-6, favorise la différenciation plasmocytaire et la production d’immunoglobulines non spécifiques (Hartmann 2012). L’activation de la voie JAK1/STAT3 en aval du récepteur de l’IL-6 constitue un mécanisme clé de cette plasmocytogenèse excessive, le facteur de transcription STAT3 phosphorylé translocant au noyau pour induire l’expression de BLIMP-1 (PRDM1), le régulateur maître de la différenciation terminale des lymphocytes B en plasmocytes (Nutt 2015).
L’association avec le virus de la leucose féline (FeLV) est moins bien documentée, avec des taux de séroprévalence oscillant entre 0 et 20 % selon les cohortes, des chiffres ne différant pas toujours significativement de la population de référence (Guaguère 2004 ; Miller 2013). La PPF peut toutefois survenir chez des chats séronégatifs pour le FIV comme pour le FeLV, ce qui indique que l’infection rétrovirale n’est ni nécessaire ni suffisante pour déclencher la maladie. Elle agit probablement comme cofacteur amplificateur d’une dysrégulation immunitaire préexistante, abaissant le seuil de tolérance et favorisant la rupture de l’homéostasie du compartiment B.
3.3. Cofacteurs environnementaux et infectieux suspectés
Au-delà des rétrovirus, d’autres agents infectieux ont été suspectés comme déclencheurs potentiels sans qu’une preuve formelle ait été apportée. Certains auteurs ont évoqué le rôle de stimulations antigéniques chroniques liées à des agents bactériens ou fongiques au contact des coussinets, mais aucune culture microbiologique systématique n’a démontré un agent pathogène spécifique associé à la maladie (Miller 2013). L’hypothèse d’une hypersensibilité de contact ou d’une réaction à corps étranger a été avancée, sans étayage expérimental. Des cas de PPF survenant après vaccination ou changement alimentaire ont été rapportés de manière anecdotique, mais aucun lien causal n’a été établi (Scarampella 2004). Le rôle de facteurs épigénétiques modulant l’expression de gènes impliqués dans la régulation du compartiment B — tels que les modifications post-traductionnelles des histones ou la méthylation de l’ADN au niveau des promoteurs de PRDM1 et IRF4 — reste un champ de recherche inexploré en médecine féline.
Immunopathologie moléculaire
4.1. Ontogénie plasmocytaire et voies de signalisation impliquées
La compréhension de la PPF requiert une connaissance fine de la biologie des plasmocytes. La différenciation terminale du lymphocyte B en plasmocyte mature sécréteur d’immunoglobulines est orchestrée par un réseau hiérarchisé de facteurs de transcription. Le facteur BLIMP-1, encodé par le gène PRDM1, agit comme répresseur transcriptionnel du programme B cellulaire, inhibant l’expression de PAX5 et BCL6, deux facteurs indispensables au maintien de l’identité du lymphocyte B germinal (Nutt 2015). Simultanément, le facteur IRF4 (MUM1) se lie en synergie avec BLIMP-1 pour activer le programme sécrétoire, induisant l’expression de XBP1, un médiateur clé de la réponse aux protéines mal repliées (unfolded protein response, UPR) qui permet l’expansion du réticulum endoplasmique nécessaire à la production massive d’immunoglobulines. Dans le contexte de la PPF, cette cascade apparaît constitutivement activée dans les plasmocytes résidents du derme des coussinets, comme le suggère l’immunomarquage intense de MUM1/IRF4 et de CD138 (syndecan-1) observé sur les biopsies (Mauldin 2016 ; Gross 2005).
La voie de signalisation IL-6/JAK1/STAT3 joue un rôle central dans l’expansion plasmocytaire. L’interleukine 6, produite localement par les macrophages et les fibroblastes dermiques en réponse à des signaux inflammatoires, se lie à son récepteur membranaire (IL-6Rα/gp130), activant la tyrosine kinase JAK1 qui phosphoryle le facteur STAT3. STAT3 phosphorylé dimérise et transloque au noyau, où il induit directement la transcription de PRDM1 et d’IRF4 (Nutt 2015). Ce circuit autocrine et paracrine pourrait être perpétué dans les coussinets par un microenvironnement riche en cytokines pro-inflammatoires, notamment le TNF-α et l’IL-1β, qui stimulent à leur tour la production d’IL-6 par les cellules stromales via l’activation de la voie canonique NF-κB (p65/RelA). La cytokine BAFF (B-cell Activating Factor, également appelée BLyS), membre de la superfamille du TNF, constitue un facteur de survie déterminant pour les plasmocytes à longue durée de vie. BAFF se lie aux récepteurs BCMA et TACI exprimés à la surface des plasmocytes, activant la voie NF-κB non canonique (RelB/p52) et inhibant l’apoptose mitochondriale par surexpression de BCL-2 et MCL-1 (Mackay 2009). Un excès de BAFF sérique, documenté dans plusieurs maladies auto-immunes humaines, pourrait constituer un mécanisme physiopathologique analogue dans la PPF, bien que le dosage de cette cytokine n’ait pas encore été réalisé spécifiquement chez le chat atteint.
4.2. Hypergammaglobulinémie et dépôts de complexes immuns
L’hypergammaglobulinémie polyclonale, retrouvée chez 50 à 63 % des chats atteints de PPF, traduit l’activation diffuse et non spécifique du compartiment plasmocytaire (Guaguère 2004). L’électrophorèse des protéines sériques révèle une élévation de la fraction gamma sans pic restreint, avec des taux d’IgG pouvant atteindre deux à trois fois la limite supérieure de la normale. La production excessive d’immunoglobulines, en l’absence d’un antigène cible identifié, conduit à la formation de complexes immuns circulants qui se déposent dans les tissus à forte vascularisation, en particulier les glomérules rénaux et le derme des coussinets. Ces dépôts ont été mis en évidence par immunofluorescence directe sous forme de dépôts granulaires d’IgG, d’IgM et de la fraction C3 du complément le long de la membrane basale épidermique et autour des parois vasculaires dermiques (Gross 2005). Le mécanisme de dépôt rappelle celui de la réaction d’hypersensibilité de type III (classification de Gell et Coombs), où les complexes immuns de taille intermédiaire échappent à la clairance par le système réticulo-endothélial et précipitent dans les parois vasculaires, déclenchant une cascade inflammatoire locale.
4.3. Activation du complément et cascade inflammatoire
Les dépôts de complexes immuns activent la voie classique du complément par fixation du fragment C1q à la portion Fc des immunoglobulines agrégées. Cette activation séquentielle (C1q → C1r/C1s → C4 → C2 → C3 convertase) aboutit au clivage de C3 en C3a (anaphylatoxine) et C3b (opsonine), puis à la formation du complexe d’attaque membranaire C5b-9 qui provoque une lyse cellulaire directe (Gross 2005). Les anaphylatoxines C3a et C5a agissent comme puissants chimioattractants pour les neutrophiles et les macrophages, amplifiant l’inflammation locale. La libération de protéases lysosomales (élastase, cathepsine G) par les neutrophiles recrutés contribue à la dégradation de la matrice extracellulaire du derme des coussinets, expliquant la texture molle et spongieuse caractéristique du tissu atteint (Miller 2013). Le dosage du C3 sérique, lorsqu’il a été réalisé, montre parfois une diminution compatible avec une consommation par activation in vivo, un phénomène classique des maladies à complexes immuns.
4.4. Métalloprotéinases matricielles et destruction tissulaire
Le remodelage destructif du tissu conjonctif des coussinets fait intervenir les métalloprotéinases matricielles (MMP), une famille d’endopeptidases zinc-dépendantes capables de dégrader les composants de la matrice extracellulaire. Les MMP-2 (gélatinase A) et MMP-9 (gélatinase B) sont particulièrement impliquées dans la dégradation du collagène de type IV et de la laminine au niveau de la membrane basale, tandis que la MMP-1 (collagénase interstitielle) clive le collagène fibrillaire de types I et III qui constitue l’essentiel de l’armature dermique du coussinet (Sapadin 2006). L’expression de ces MMP est induite par le TNF-α et l’IL-1β via l’activation du facteur de transcription AP-1 (c-Fos/c-Jun) et de la voie NF-κB. La destruction collagénique progressive, combinée à l’œdème inflammatoire et à l’infiltration cellulaire massive, aboutit à l’augmentation de volume caractéristique du coussinet, dont la consistance passe de ferme à pâteuse. Le rôle central des MMP dans la pathogénie offre un rationnel pharmacologique direct pour l’utilisation de la doxycycline, dont l’activité inhibitrice sur les MMP constitue l’un des mécanismes d’action les mieux documentés indépendamment de son activité antibactérienne (Griffin 2010).
Présentation clinique
5.1. Sémiologie des coussinets
Le tableau clinique de la PPF est habituellement caractéristique et permet une orientation diagnostique dès l’examen macroscopique. La lésion élémentaire consiste en un gonflement diffus et symétrique d’un ou plusieurs coussinets, conférant au coussinet atteint un aspect tumescent, arrondi, sensiblement plus volumineux que la normale. Les coussinets métacarpiens et métatarsiens centraux sont atteints de manière préférentielle dans plus de 80 % des cas, bien que les coussinets digitaux puissent également être impliqués (Miller 2013). L’atteinte est le plus souvent bilatérale et touche simultanément les quatre membres dans environ 50 % des cas rapportés (Guaguère 2004). La surface du coussinet présente une coloration violet bleuté à lilas, parfois décrite comme une cyanose locale, qui traduit l’engorgement vasculaire et l’inflammation dermique profonde. Cette teinte s’observe surtout sur les coussinets à pigmentation claire et peut être masquée sur les coussinets naturellement foncés. Un signe sémiologique très évocateur réside dans l’aspect strié de la surface, avec de fines stries blanchâtres entrecroisées formant un réseau en filet (cross-hatching), qui résulte de la tension exercée par le tissu oedématié sur l’épiderme aminci du coussinet (Gross 2005). La palpation révèle une consistance molle et pâteuse, nettement distincte de la fermeté normale du coussinet sain, traduisant la destruction de l’architecture collagénique dermique et l’infiltration cellulaire massive. La douleur est généralement absente aux stades précoces, et la boiterie, quand elle est présente, traduit le plus souvent une ulcération secondaire.
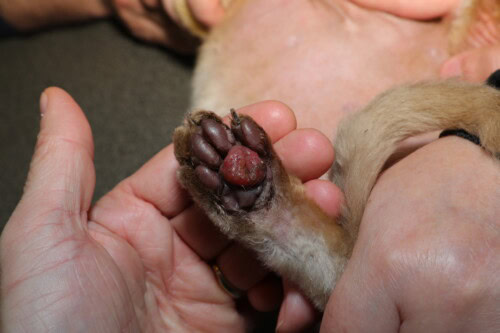
Forme évoluée avec ouverture du coussinet central
5.2. Évolution naturelle et complications
L’évolution de la PPF est variable et imprévisible. Une proportion significative de cas, estimée entre 10 et 30 %, peut présenter une résolution spontanée sans intervention thérapeutique, dans un délai de quelques semaines à quelques mois (Miller 2013). Cette régression spontanée renforce l’hypothèse d’un processus réactionnel à un stimulus antigénique transitoire. Cependant, l’évolution vers l’ulcération constitue la complication la plus redoutée, survenant dans 30 à 50 % des cas non traités (Guaguère 2004). L’ulcération se manifeste par une perte de substance de l’épiderme du coussinet, exposant le derme infiltré et fragile, souvent accompagnée d’une hémorragie secondaire parfois profuse en raison de la néovascularisation inflammatoire et de la fragilité des parois vasculaires fragilisées par les dépôts de complexes immuns et l’action des MMP (Taylor 1990). La surinfection bactérienne de l’ulcère constitue un risque additionnel, bien qu’elle ne soit pas systématique. La douleur accompagnant l’ulcération provoque alors une boiterie marquée, une réticence au déplacement et parfois un léchage compulsif qui entretient le phénomène érosif. Quelques cas exceptionnels de saignements récurrents ayant conduit à une anémie ferriprive ont été documentés, soulignant la nécessité d’un suivi hématologique chez les chats présentant des ulcérations chroniques (Taylor 1990).
5.3. Manifestations extra-podales associées
La PPF ne se limite pas toujours à une atteinte podologique isolée. Des associations avec d’autres manifestations plasmocytaires ont été documentées, suggérant un processus systémique sous-jacent. La stomatite plasmocytaire, caractérisée par une infiltration plasmocytaire de la muqueuse buccale (en particulier du palais et des arcades glosso-palatines), a été décrite en concomitance avec la PPF dans 10 à 20 % des cas selon les séries (Miller 2013 ; Guaguère 2004). L’association simultanée de ces deux entités chez un même animal constitue un argument fort en faveur d’un désordre systémique du compartiment B. Des atteintes rénales, sous forme de glomérulonéphrite à dépôts de complexes immuns ou, plus rarement, d’amylose rénale réactive de type AA, ont été rapportées chez des chats atteints de PPF chronique (Dias Pereira 2003). Le dépôt de substance amyloïde, constitué de fibrilles issues de la protéine sérique amyloïde A (SAA) produite en excès par le foie sous la stimulation de l’IL-6 et du TNF-α lors d’inflammation chronique, peut conduire à une insuffisance rénale progressive. Ces associations morbides confèrent à la PPF une dimension systémique qui dépasse le cadre strictement dermatologique et justifie un bilan biologique complet chez tout chat diagnostiqué.
Démarche diagnostique
6.1. Examen clinique et critères d’orientation
Le diagnostic de la PPF repose sur un faisceau d’arguments cliniques, cytologiques et histopathologiques. L’examen clinique attentif des quatre membres, incluant l’inspection et la palpation de tous les coussinets, constitue la première étape. La conjonction d’un gonflement non douloureux d’un ou plusieurs coussinets centraux, d’une teinte violacée et d’une consistance pâteuse chez un chat adulte oriente fortement le diagnostic. L’examen dermatologique complet doit rechercher d’éventuelles lésions cutanées associées sur d’autres sites, ainsi qu’un examen de la cavité buccale à la recherche d’une stomatite plasmocytaire concomitante. L’évaluation de l’état général, de la palpation rénale et du statut ganglionnaire fait partie du bilan clinique initial (Miller 2013).
6.2. Apport de la cytologie
La cytoponction à l’aiguille fine du coussinet gonflé, réalisée avec une aiguille de 22 à 25 gauge, constitue un examen complémentaire rapide et peu invasif, praticable en consultation. L’étalement sur lame et la coloration au May-Grünwald-Giemsa (MGG) ou au Diff-Quick révèlent un infiltrat cellulaire composé à plus de 80 % de plasmocytes matures, reconnaissables à leur noyau excentré, leur chromatine en « rayon de roue » et leur cytoplasme basophile abondant avec un halo périnucléaire clair correspondant à l’appareil de Golgi hypertrophié (Gross 2005). La présence de cellules de Mott, plasmocytes dont le cytoplasme est distendu par de multiples inclusions éosinophiles sphériques correspondant à des corps de Russell (immunoglobulines agrégées dans le réticulum endoplasmique dilaté), est un signe hautement évocateur de la PPF. Ces inclusions résultent d’un dysfonctionnement de la voie UPR (XBP1-dépendante) ne parvenant plus à gérer la surcharge de protéines sécrétoires (Nutt 2015). La cytologie, bien qu’orientant fortement le diagnostic, ne permet pas à elle seule d’exclure un plasmocytome extramédullaire, et la confirmation histopathologique reste recommandée dans les cas atypiques ou unilatéraux.
6.3. Histopathologie : le standard diagnostique
La biopsie cutanée, prélevée au bistouri en coin (wedge biopsy) ou au trépan à biopsie (punch de 6 mm), fournit le diagnostic définitif. L’examen histopathologique révèle un infiltrat dermique diffus ou nodulaire composé quasi exclusivement de plasmocytes matures, occupant le derme superficiel et profond, souvent étendu au tissu sous-cutané (Gross 2005 ; Mauldin 2016). Les plasmocytes sont bien différenciés, sans atypie cytonucléaire significative, et l’indice mitotique est faible, généralement inférieur à 1 mitose par champ à fort grossissement (×400), ce qui distingue formellement la PPF d’un plasmocytome. L’architecture lobulaire du tissu adipeux du coussinet est respectée mais envahie par l’infiltrat. La membrane basale épidermique apparaît souvent amincie, et l’épiderme recouvrant est atrophique, ce qui prédispose à l’ulcération. Une vascularite leukocytoclasique, avec nécrose fibrinoïde de la paroi des artérioles dermiques et infiltration pariétale par des neutrophiles à noyaux fragmentés, accompagne fréquemment l’infiltrat plasmocytaire et témoigne de la participation des complexes immuns à la pathogénie (Gross 2005). L’immunohistochimie confirme l’expression de CD79a (marqueur pan-B), de CD138 et de MUM1/IRF4 par les plasmocytes, avec une expression polyclonale des chaînes légères kappa et lambda excluant une prolifération monoclonale (Mauldin 2016). Les corps de Russell sont mis en évidence par la coloration au PAS (Periodic Acid-Schiff), apparaissant comme des inclusions intracytoplasmiques PAS-positives et diastase-résistantes.
6.4. Bilan biologique et sérologique
Le bilan biologique complète le tableau diagnostique et fournit des informations pronostiques. L’hémogramme peut révéler une lymphocytose modérée chez certains chats, ainsi qu’une anémie régénérative en cas d’hémorragies chroniques à partir de coussinets ulcérés. L’électrophorèse des protéines sériques constitue un examen clé, mettant en évidence l’hypergammaglobulinémie polyclonale dans 50 à 63 % des cas, avec des taux de protéines totales parfois supérieurs à 90 g/L (Guaguère 2004). Le dosage des immunoglobulines spécifiques, lorsqu’il est disponible, montre une élévation prédominante des IgG, mais les IgA et IgM peuvent également être augmentées. La sérologie FIV et FeLV est systématiquement recommandée, réalisée par immunochromatographie rapide (détection d’anticorps anti-FIV et d’antigène p27 FeLV) ou par ELISA, avec confirmation par PCR en cas de discordance clinique (Hartmann 2012). La biochimie rénale (créatinine, SDMA, rapport protéines/créatinine urinaire) doit être évaluée pour détecter une éventuelle glomérulonéphrite à complexes immuns ou une amylose rénale associée. La recherche d’ANA par immunofluorescence indirecte sur cellules HEp-2 complète le bilan immunologique, bien que sa valeur prédictive positive reste modeste chez le chat (Dias Pereira 2003).
6.5. Diagnostic différentiel
Le diagnostic différentiel de la PPF inclut plusieurs entités affectant les coussinets du chat. Le plasmocytome extramédullaire, rare en localisation podale, se distingue par son caractère généralement solitaire, unilatéral, et par un indice mitotique plus élevé (> 5 mitoses/10 champs ×400) associé à une monoclonalité à l’immunohistochimie (Mauldin 2016). Le granulome éosinophilique pouvant affecter les coussinets se caractérise par un infiltrat à dominante éosinophilique avec des images de collagénolyse flamme. La pododermatite bactérienne présente des signes d’infection (exsudat purulent, tuméfaction chaude, douleur marquée). Le pemphigus foliacé, cause fréquente de pododermatite croûteuse chez le chat, se distingue par la présence de pustules, de croûtes et d’acantholyse à la cytologie et l’histologie. Les carcinomes épidermoïdes des coussinets, observés surtout chez les chats blancs, se présentent typiquement par des lésions ulcéro-prolifératives asymétriques. La mastocytose cutanée diffuse, bien que très rare, peut mimer un gonflement des coussinets (Miller 2013 ; Hnilica 2017).
Prise en charge thérapeutique
7.1. Abstention thérapeutique et résolution spontanée
La possibilité d’une résolution spontanée, documentée dans 10 à 30 % des cas, constitue un élément décisionnel fondamental (Miller 2013). Chez les chats présentant une atteinte limitée, non ulcérée et non douloureuse, une période d’observation de quatre à six semaines peut être envisagée avant toute intervention pharmacologique, avec un suivi clinique rapproché. Cette approche dite de « watchful waiting » se justifie d’autant plus que les traitements disponibles ne sont pas dénués d’effets secondaires et que la maladie n’engage pas le pronostic vital en l’absence de complications. La décision de traiter repose sur la présence d’une ulcération, d’une douleur, d’une boiterie, d’hémorragies récurrentes ou d’une progression des lésions malgré la surveillance (Bettenay 2003).
7.2. Doxycycline : rationnel pharmacologique et données d’efficacité
La doxycycline constitue, depuis les travaux pionniers de Bettenay et collaborateurs, le traitement de première intention le plus largement documenté dans la prise en charge de la pododermatite plasmocytaire féline. Son recours ne repose pas sur une action antibactérienne — l’affection n’ayant pas d’étiologie infectieuse bactérienne démontrée — mais sur ses propriétés immunomodulatrices pléiotropes, partagées avec l’ensemble de la famille des tétracyclines (Bettenay 2003). Sur le plan moléculaire, la doxycycline inhibe l’activité de plusieurs métalloprotéinases matricielles (MMP), en particulier la MMP-2 et la MMP-9, par chélation des ions zinc nécessaires à leur site catalytique. Cette inhibition limite la dégradation du collagène de type IV et de la membrane basale, processus directement impliqué dans le remodelage tissulaire destructeur observé au sein des coussinets atteints (Guaguère 2004). Par ailleurs, la doxycycline exerce une action anti-inflammatoire en réduisant la production de prostaglandine E2 (PGE2) via la suppression de l’expression de la cyclo-oxygénase 2 (COX-2) dans les macrophages activés, et en diminuant la synthèse d’oxyde nitrique (NO) par inhibition de la NO synthase inductible (iNOS) (Sapadin 2006).
Un mécanisme additionnel, souvent sous-estimé dans la littérature vétérinaire, concerne la capacité de la doxycycline à moduler l’activation lymphocytaire T. Des travaux menés in vitro démontrent que les tétracyclines réduisent la prolifération des lymphocytes T stimulés par les mitogènes et diminuent l’expression du complexe majeur d’histocompatibilité de classe II (CMH-II) à la surface des cellules présentatrices d’antigènes, atténuant ainsi la boucle d’amplification immunitaire adaptative (Niimi 1998). Dans le contexte de la pododermatite plasmocytaire, où l’hypergammaglobulinémie polyclonale reflète une activation B dérégulée, cette action sur la présentation antigénique revêt une pertinence physiopathologique directe.
Le protocole thérapeutique standard repose sur l’administration orale de doxycycline à la posologie de 10 mg/kg une fois par jour, pendant une durée minimale de six à huit semaines (Bettenay 2003). L’observance peut être compromise par le risque de sténose œsophagienne, complication spécifique au chat, induite par la rétention du comprimé dans l’œsophage et la libération locale d’un pH acide provoquant une nécrose muqueuse focale. La prévalence de cette complication a été estimée à environ 3 à 5 % des chats recevant des formes solides de doxycycline sans suivi hydrique (German 2005). L’administration systématique d’un bolus aqueux de 3 à 6 mL d’eau après chaque prise, ou le recours à une formulation liquide, réduit considérablement ce risque. Les données rétrospectives compilées par Guaguère et Bensignor rapportent un taux de réponse clinique complet ou partiel de 50 à 65 % après un premier cycle de doxycycline, avec une amélioration observable dès la troisième semaine de traitement chez les répondeurs (Guaguère 2004). La résolution se manifeste par une diminution progressive de la tuméfaction podal, une repigmentation des coussinets et une régression des stries blanchâtres caractéristiques.
Les rechutes après arrêt du traitement constituent une réalité clinique fréquente, documentée chez environ 30 à 50 % des cas initialement répondeurs dans un délai de trois à six mois (Scarampella 2018). Cette observation suggère que la doxycycline ne corrige pas le mécanisme pathogénique sous-jacent mais en atténue les manifestations effectrices. La question d’un traitement d’entretien à dose réduite (5 mg/kg/jour ou un jour sur deux) reste débattue faute d’essai contrôlé, bien que certains cliniciens y recourent empiriquement avec des résultats jugés satisfaisants dans les formes chroniques récidivantes.
7.3. Glucocorticoïdes systémiques
Les glucocorticoïdes systémiques représentent la deuxième ligne thérapeutique la plus fréquemment employée, en particulier lorsque la doxycycline s’avère insuffisante ou lorsque la sévérité clinique impose une immunosuppression rapide. Leur mécanisme d’action repose sur la liaison au récepteur cytoplasmique des glucocorticoïdes (GR), qui, après translocation nucléaire, agit comme facteur de transcription modulant l’expression de plus de 200 gènes impliqués dans la réponse immunitaire et inflammatoire (Cain 2017). L’effet anti-inflammatoire principal passe par l’inhibition du facteur de transcription NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells), bloquant ainsi la transcription de l’interleukine-1β (IL-1β), de l’IL-6, du TNF-α et de multiples chimiokines responsables du recrutement plasmocytaire au sein du derme podal.
La prednisolone, administrée per os à la dose de 1 à 2 mg/kg/jour pendant deux à quatre semaines puis en décroissance progressive sur quatre à six semaines, produit une réponse clinique dans 60 à 70 % des cas selon les séries rétrospectives publiées (Taylor 2004). L’acétate de méthylprednisolone en injection sous-cutanée (4 mg/kg) a été utilisé dans les cas réfractaires, avec une efficacité rapportée mais un profil de tolérance moins favorable à long terme en raison de la durée d’action prolongée et de l’impossibilité d’ajustement posologique (Guaguère 2004). Les effets indésirables dose-dépendants — polyuro-polydipsie, polyphagie, susceptibilité accrue au diabète sucré, infections urinaires — limitent l’usage au long cours chez le chat, espèce notoirement sensible à la résistance insulinique induite par les corticoïdes. Le développement d’un diabète sucré iatrogène a été estimé à 5 à 10 % chez les chats recevant des glucocorticoïdes pendant plus de trois mois, cette prévalence variant selon la dose cumulée et les facteurs de risque individuels tels que l’obésité et l’âge avancé (Lowe 2008).
Le sevrage des glucocorticoïdes constitue un temps thérapeutique délicat. Une décroissance trop rapide expose à la rechute, tandis qu’un maintien prolongé majore les risques iatrogènes. L’association initiale doxycycline–prednisolone, avec relais par la doxycycline seule après obtention de la rémission clinique, offre un compromis pragmatique souvent adopté en pratique spécialisée (Scarampella 2018).
7.4. Ciclosporine et inhibiteurs de la calcineurine
La ciclosporine (ciclosporine A, CsA) a émergé comme alternative thérapeutique de choix dans les formes réfractaires de pododermatite plasmocytaire féline. Son mécanisme d’action, distinct de celui des glucocorticoïdes, repose sur la formation d’un complexe avec la cyclophiline intracellulaire ; ce complexe inhibe la calcineurine, phosphatase calcium-dépendante indispensable à la déphosphorylation du facteur de transcription NFAT (Nuclear Factor of Activated T-cells). Le blocage de NFAT empêche la transcription de l’IL-2, cytokine majeure de la prolifération clonale des lymphocytes T helper, et réduit consécutivement l’aide T fournie aux lymphocytes B pour la commutation isotypique et la différenciation plasmocytaire (Robson 2003). Dans une maladie caractérisée par une infiltration plasmocytaire dense et une hypergammaglobulinémie, ce ciblage du dialogue T-B revêt une pertinence physiopathologique directe.
La posologie recommandée chez le chat est de 5 à 7 mg/kg/jour par voie orale, en administration à jeun pour optimiser la biodisponibilité, qui varie de 25 à 35 % selon les individus (Latimer 2014). Plusieurs séries de cas rapportent des taux de réponse de 60 à 85 % avec la ciclosporine, y compris chez des animaux n’ayant pas répondu à la doxycycline ou aux glucocorticoïdes (Bettenay 2003 ; Scarampella 2018). Le délai d’action est généralement de quatre à six semaines, délai cohérent avec le mode d’action sur la réponse immunitaire adaptative. Les effets indésirables digestifs — vomissements, diarrhée — affectent environ 15 à 25 % des chats en début de traitement, mais se résolvent fréquemment par une introduction progressive de la dose sur une semaine ou par une administration concomitante avec une petite quantité de nourriture (Roberts 2016).
Le risque infectieux opportuniste mérite une surveillance attentive. La réactivation de la toxoplasmose, bien que rarement documentée sous ciclosporine chez le chat, a été rapportée lors d’immunosuppression prolongée et constitue une contre-indication relative chez les individus séronégatifs exposés à un environnement à risque (Last 2004). Un bilan sérologique Toxoplasma gondii pré-thérapeutique est recommandé par plusieurs experts, bien que le niveau de preuve reste limité pour cette indication spécifique. Le tacrolimus topique (FK-506), autre inhibiteur de la calcineurine, n’a pas fait l’objet d’études ciblées dans la pododermatite plasmocytaire, probablement en raison de la difficulté d’application sur la surface irrégulière des coussinets et de la faible pénétration percutanée à travers l’épiderme podal épaissi.
7.5. Autres immunomodulateurs
Plusieurs agents immunomodulateurs ont été employés ponctuellement, sans qu’aucun ne bénéficie d’un niveau de preuve équivalent à celui de la doxycycline ou de la ciclosporine. Le chlorambucil, agent alkylant de la famille des moutardes azotées, a été utilisé dans des formes sévères et récalcitrantes à la posologie de 0,1 à 0,2 mg/kg un jour sur deux, en association avec la prednisolone (Taylor 2004). Son mécanisme repose sur l’alkylation de l’ADN des lymphocytes en prolifération, induisant des liaisons interbrins qui empêchent la réplication et la transcription, avec une action préférentielle sur les lignées lymphocytaires B, ce qui justifie théoriquement son emploi dans une maladie à médiation plasmocytaire. Le profil de toxicité hématologique impose un suivi par numération formule sanguine toutes les deux à trois semaines pendant les deux premiers mois de traitement. Une myélosuppression significative, définie par une neutropénie inférieure à 2 500/μL, survient chez environ 10 à 15 % des chats traités et impose une suspension temporaire (Lowe 2008).
Le mycophénolate mofétil, inhibiteur sélectif et réversible de l’inosine monophosphate déshydrogénase (IMPDH), enzyme clef de la synthèse de novo des purines dans les lymphocytes, a été rapporté anecdotiquement dans quelques cas de pododermatite plasmocytaire avec des résultats variables, à la posologie de 10 mg/kg deux fois par jour per os (Backel 2013). L’absence d’essai contrôlé et la rareté des données pharmacocinétiques chez le chat limitent sa recommandation.
Les interférons recombinants représentent une approche immunomodulatrice distincte. L’interféron oméga félin recombinant (rFeIFN-ω), dont l’action passe par l’activation de la voie JAK-STAT (en particulier STAT1 et STAT2) via le récepteur de type I aux interférons, induit l’expression de gènes stimulés par l’interféron (ISGs) et module la balance Th1/Th2, ce qui pourrait théoriquement corriger le biais immunitaire sous-jacent à l’infiltration plasmocytaire (de Mari 2004). Quelques cas cliniques ont rapporté une amélioration après injection sous-cutanée ou per-muqueuse d’interféron oméga, mais les données restent trop sporadiques pour tirer des conclusions solides.
7.6. Traitement chirurgical
L’exérèse chirurgicale des coussinets atteints constitue une option réservée aux formes focales sévèrement ulcérées avec complications septiques secondaires ou aux cas totalement réfractaires à l’ensemble des options médicales. La podoplastie a été décrite dans des rapports de cas isolés, avec résection du tissu gravement remanié suivie d’une fermeture par lambeau d’avancement ou cicatrisation par seconde intention sous pansement semi-occlusif (Guaguère 2004). Les résultats fonctionnels dépendent de l’étendue de la résection et du nombre de coussinets impliqués. L’atteinte multipodale, qui concerne 40 à 50 % des cas, rend cette approche techniquement difficile et éthiquement discutable lorsqu’elle impliquerait une résection bilatérale de coussinets porteurs.
L’amputation digitale a été rapportée dans de rares situations où un seul coussinet digital présentait une tuméfaction irréductible avec ulcération profonde et ostéomyélite secondaire, mais cette éventualité reste exceptionnelle dans la pododermatite plasmocytaire, qui n’atteint que rarement l’os sous-jacent (Taylor 2004). Le recours au laser CO₂ pour la vaporisation contrôlée du tissu excédentaire a été mentionné empiriquement, mais aucune étude n’en évalue formellement l’efficacité ni le profil de cicatrisation dans cette indication précise. La prise en charge post-opératoire implique systématiquement un traitement immunomodulateur concomitant pour prévenir la récidive locale, confirmant que la chirurgie ne traite que la conséquence tissulaire sans corriger la dysrégulation immunitaire causale.
Pronostic et suivi à long terme
8.1. Taux de réponse et durée de rémission
L’évaluation pronostique de la pododermatite plasmocytaire féline repose sur des données essentiellement rétrospectives, l’absence d’essais contrôlés randomisés constituant une limitation majeure dans l’appréciation comparative des taux de réponse thérapeutique. Les séries publiées, regroupant collectivement entre 100 et 150 cas documentés au cours des trois dernières décennies, convergent vers un profil pronostique globalement favorable pour les formes non ulcérées prises en charge précocement (Guaguère 2004 ; Scarampella 2018). Le taux de rémission complète, défini comme la résolution clinique totale des lésions podales et la normalisation de la texture des coussinets, varie de 30 à 50 % selon les publications et le traitement employé. La rémission partielle, caractérisée par une amélioration clinique supérieure à 50 % mais avec persistance d’un épaississement ou d’une dépigmentation résiduelle, concerne 20 à 30 % supplémentaires des cas traités.
L’histoire naturelle de la maladie est remarquable par la possibilité de rémissions spontanées, rapportées dans 10 à 20 % des cas selon la série rétrospective la plus complète publiée à ce jour (Bettenay 2003). Ce phénomène, exceptionnel dans les maladies à médiation immunitaire félines, soulève la question d’une régulation immunologique endogène capable de restaurer la tolérance ou de supprimer le clone plasmocytaire pathogène. L’hypothèse d’une modulation par les lymphocytes T régulateurs (Treg), via la production d’IL-10 et de TGF-β, qui exercent une rétroaction négative sur la différenciation B et la survie plasmocytaire, pourrait expliquer ce phénomène d’auto-résolution (Groux 1997). La démonstration directe de cette hypothèse dans la pododermatite plasmocytaire reste cependant à établir par des études d’immunophénotypage dynamique.
La durée de rémission après traitement médical varie considérablement. Chez les répondeurs à la doxycycline, la durée médiane de rémission a été estimée entre trois et douze mois, avec une distribution bimodale : un groupe de répondeurs durables (rémission supérieure à un an) et un groupe de rechuteurs précoces (rémission inférieure à trois mois) (Scarampella 2018). Cette hétérogénéité suggère l’existence de sous-populations pathogéniquement distinctes, potentiellement identifiables par des biomarqueurs immunologiques ou histopathologiques qui restent à définir. Sous ciclosporine, les rémissions prolongées apparaissent plus fréquentes, avec des durées médianes rapportées de six à dix-huit mois, bien que la dépendance thérapeutique — nécessité de maintenir un traitement d’entretien à faible dose — concerne une proportion significative de cas (Bettenay 2003).
8.2. Facteurs pronostiques identifiés
L’identification de facteurs pronostiques fiables demeure un défi en l’absence de cohortes prospectives de taille suffisante. Plusieurs paramètres cliniques et biologiques ont été associés, de manière rétrospective et avec des niveaux de significativité variables, à la probabilité de réponse thérapeutique. Le degré d’ulcération au moment du diagnostic constitue le facteur pronostique négatif le plus régulièrement identifié : les coussinets présentant une ulcération profonde avec exposition du derme sous-jacent répondent moins favorablement à la doxycycline seule et nécessitent plus fréquemment le recours à une immunosuppression de deuxième ligne (Taylor 2004). L’explication physiopathologique réside dans le remodelage fibreux irréversible et la colonisation bactérienne secondaire qui entretiennent le cercle inflammatoire local indépendamment du mécanisme immunologique primaire.
Le taux de gammaglobulines sériques au diagnostic semble corrélé inversement au pronostic : les chats présentant une hypergammaglobulinémie marquée (supérieure à 20 g/L) affichent des taux de rémission complète plus faibles que ceux dont les gammaglobulines restent modérément élevées (Gruffydd-Jones 1980 ; Guaguère 2004). Cette observation renforce l’idée d’un continuum de sévérité reflété par l’amplitude de l’activation immunitaire systémique. Le nombre de coussinets atteints au moment de la présentation initiale a également été corrélé au pronostic : l’atteinte de quatre coussinets ou plus est associée à une probabilité de rechute significativement supérieure à celle observée dans les formes monopodale ou bipodale (Scarampella 2018). La sérologie FIV, lorsqu’elle est positive, ne semble pas influencer de manière déterminante la réponse thérapeutique dans les séries disponibles, bien que le nombre de cas co-infectés reste trop faible pour tirer des conclusions statistiquement robustes (Bettenay 2003).
L’âge au diagnostic n’a pas été identifié comme facteur pronostique indépendant de manière reproductible, bien que certains auteurs rapportent une tendance à des formes plus sévères et plus récidivantes chez les individus de moins de trois ans, potentiellement liée à une immaturité des mécanismes de tolérance immunologique (Taylor 2004). Le développement de scores cliniques standardisés, intégrant l’étendue lésionnelle, le degré d’ulcération, les paramètres biologiques et l’immunophénotype infiltrant, constitue un besoin non satisfait qui permettrait d’homogénéiser l’évaluation pronostique et la comparaison entre études.
Comorbidités et concept de syndrome plasmocytaire félin
9.1. Stomatite plasmocytaire
L’association entre pododermatite plasmocytaire féline et stomatite plasmocytaire (également désignée gingivostomatite chronique féline à prédominance plasmocytaire) est reconnue depuis les descriptions princeps de la maladie et constitue l’argument clinique le plus solide en faveur d’un syndrome plasmocytaire systémique chez le chat (Gruffydd-Jones 1980). La prévalence de la co-occurrence varie de 10 à 35 % selon les séries, la fourchette haute étant rapportée dans les études qui ont systématiquement exploré la cavité buccale chez les chats atteints de pododermatite (Guaguère 2004 ; Scarampella 2018). La stomatite plasmocytaire se caractérise histologiquement par un infiltrat plasmocytaire dense de la lamina propria gingivale et buccale, avec des cellules de Mott et des corps de Russell identiques à ceux observés dans les coussinets. L’analyse immunohistochimique révèle une prédominance d’IgG polyclonales, similaire au profil sérique, et une surexpression locale de l’IL-1β, de l’IL-6 et du TNF-α dans les muqueuses atteintes (Harley 2003).
Sur le plan moléculaire, la stomatite féline chronique a été associée à une activation de la voie NF-κB et à une surexpression de RANKL (Receptor Activator of Nuclear Factor Kappa-B Ligand) dans les tissus gingivaux, contribuant à la résorption osseuse alvéolaire observée dans les formes avancées (Arzi 2010). Cette dernière voie distingue la stomatite de la pododermatite, où la composante ostéolytique est absente ou minimale. La co-morbidité stomatite-pododermatite ne semble pas liée au statut FIV ou FeLV de manière exclusive, puisqu’elle est documentée chez des chats séronégatifs pour ces deux rétrovirus (Bettenay 2003). Ce constat renforce l’hypothèse d’un terrain immunologique commun prédisposant à l’activation plasmocytaire aberrante dans des sites anatomiques distincts partageant des caractéristiques d’exposition antigénique (muqueuses buccales et épithélium podal, tous deux soumis à des stimulations mécaniques et microbiennes chroniques).
9.2. Glomérulonéphrite et amylose rénale
L’atteinte rénale constitue une complication potentiellement grave de la pododermatite plasmocytaire féline, rapportée dans un nombre limité mais significatif de cas. La glomérulonéphrite à complexes immuns a été documentée histologiquement chez des chats présentant une pododermatite plasmocytaire associée à une protéinurie et une azotémie progressives (Gruffydd-Jones 1980). Le mécanisme pathogénique implique le dépôt de complexes immuns circulants — formés par les immunoglobulines polyclonales en excès et leurs antigènes correspondants — dans le mésangium glomérulaire et le long de la membrane basale glomérulaire, avec activation locale du complément par la voie classique (C1q → C4 → C2 → C3) et recrutement de neutrophiles et de macrophages contribuant aux lésions endothéliales et podocytaires (Center 1990).
L’amylose rénale de type AA a été rapportée dans de rares cas de pododermatite plasmocytaire chronique, la protéine amyloïde sérique A (SAA) étant une protéine de phase aiguë synthétisée par les hépatocytes sous l’effet de l’IL-6 et de l’IL-1β — cytokines dont la production est chroniquement élevée dans l’inflammation plasmocytaire systémique (DiBartola 1997). La prévalence exacte de l’atteinte rénale reste difficile à estimer en l’absence d’évaluation systématique de la protéinurie et de la fonction rénale dans les cohortes publiées. Cependant, la recommandation d’un rapport protéine/créatinine urinaire (RPCU) au diagnostic et en suivi longitudinal apparaît justifiée chez les chats présentant une hypergammaglobulinémie marquée ou une maladie chronique évoluant depuis plus de six mois (Scarampella 2018).
9.3. Vers un spectre nosologique unifié
L’accumulation des observations cliniques et histopathologiques conduit à envisager la pododermatite plasmocytaire non comme une entité dermatologique isolée, mais comme la manifestation podale d’un syndrome plasmocytaire systémique félin. Ce concept, implicite dans les travaux de Gruffydd-Jones dès 1980, a été formalisé par Guaguère et Bensignor, qui proposent un cadre nosologique intégrant la pododermatite, la stomatite plasmocytaire, la glomérulonéphrite à complexes immuns et, plus rarement, la dermatite plasmocytaire extrapodale affectant le pavillon auriculaire ou le planum nasale (Guaguère 2004). L’unité physiopathologique de ce spectre repose sur le dénominateur commun d’une dysrégulation de la différenciation terminale B-plasmocytaire, avec production polyclonale excessive d’immunoglobulines et dépôt tissulaire de plasmocytes dans des sites anatomiques prédisposés par leur microenvironnement immunitaire local.
Ce modèle rappelle, par analogie, les gammapathies monoclonales de signification indéterminée (MGUS) et les syndromes lymphoprolifératifs à bas grade de la médecine humaine, sans que l’on puisse établir un parallèle strict en raison du caractère polyclonal — et non monoclonal — de l’activation B observée dans le syndrome plasmocytaire félin (Mellor 2006). La frontière entre activation polyclonale réactionnelle et prolifération clonale pré-néoplasique mériterait d’être explorée par des techniques de clonalité B (PCR-PARR, pour PCR for Antigen Receptor Rearrangement), qui permettraient de détecter un éventuel sous-clone dominant au sein de l’infiltrat apparemment polyclonal. L’étude de Werner et collaborateurs, ayant appliqué la technique PARR à des biopsies de pododermatite plasmocytaire, a confirmé le caractère polyclonal dans la majorité des cas testés, mais un réarrangement oligoclonal a été identifié dans environ 15 % des échantillons, ouvrant la question d’une possible progression vers un lymphome de type MALT (Mucosa-Associated Lymphoid Tissue) dans certains cas chroniques (Werner 2011).
Perspectives et axes de recherche
10.1. Biomarqueurs diagnostiques et pronostiques
Le développement de biomarqueurs objectifs, non invasifs ou peu invasifs, représente une priorité pour améliorer le diagnostic précoce, le suivi thérapeutique et la stratification pronostique de la pododermatite plasmocytaire féline. L’électrophorèse des protéines sériques, bien qu’utile pour documenter l’hypergammaglobulinémie, manque de spécificité et de sensibilité pour le suivi longitudinal. Le dosage des chaînes légères libres sériques (sFLC, serum free light chains), largement utilisé en hématologie humaine pour le monitoring des gammapathies monoclonales et des myélomes, constitue un candidat biomarqueur pertinent. Les chaînes légères kappa et lambda libres sont produites en excès lors de l’activation plasmocytaire et leur rapport κ/λ reflète l’équilibre ou le déséquilibre clonal de la population B (Bradwell 2001). Un test ELISA adapté aux immunoglobulines félines a été développé, mais sa validation analytique et clinique dans le contexte spécifique de la pododermatite plasmocytaire reste à réaliser (Tasca 2018).
Les cytokines sériques offrent un autre axe d’exploration biomarqueur. Le dosage de l’IL-6, dont le rôle dans la survie plasmocytaire via l’activation de STAT3 est bien établi en oncologie humaine (Kishimoto 2005), pourrait permettre d’identifier les patients à risque de formes systémiques (glomérulonéphrite, amylose). De même, le BAFF sérique (B-cell Activating Factor of the TNF Family), cytokine majeure de la survie des lymphocytes B matures et des plasmocytes via l’activation de la voie NF-κB non canonique (RelB/p52), constitue une cible biomarqueur et thérapeutique potentielle. Des niveaux élevés de BAFF ont été corrélés à la sévérité des maladies auto-immunes systémiques chez l’Homme (lupus érythémateux systémique, syndrome de Sjögren), et l’extrapolation au syndrome plasmocytaire félin paraît biologiquement fondée, bien que non encore explorée expérimentalement (Mackay 2009).
L’avènement de la transcriptomique tissulaire par séquençage ARN (RNA-seq) appliqué aux biopsies de coussinets permettrait de cartographier l’expression génique de l’infiltrat plasmocytaire, d’identifier des signatures moléculaires associées à la réponse thérapeutique et potentiellement de découvrir des cibles thérapeutiques jusqu’ici insoupçonnées. Le coût décroissant du séquençage de nouvelle génération rend cette approche réalisable dans le cadre d’études multicentriques, pour peu qu’une biobanque de tissus soit constituée de manière coordonnée.
10.2. Thérapies ciblées émergentes
Au-delà des JAKinibs déjà évoqués, plusieurs classes thérapeutiques émergentes en médecine humaine pourraient trouver une application dans le syndrome plasmocytaire félin. Les anticorps anti-BAFF (bélimumab) et les anti-APRIL (A PRoliferation-Inducing Ligand, ligand apparenté au BAFF), qui bloquent les signaux de survie plasmocytaire, ont démontré une efficacité dans le lupus humain avec une réduction significative des titres d’auto-anticorps et une diminution de l’activité de la maladie (Furie 2011). Le développement d’anticorps monoclonaux félins-spécifiques anti-BAFF représenterait une avancée considérable, mais se heurte aux obstacles habituels de coût de développement, de production en milieu GMP (Good Manufacturing Practice) et d’essais cliniques vétérinaires réglementés.
Les inhibiteurs du protéasome, tels que le bortézomib, qui induisent l’apoptose des plasmocytes par accumulation de protéines mal repliées et activation de la voie de stress du réticulum endoplasmique (UPR, Unfolded Protein Response), constituent une approche séduisante pour cibler sélectivement les cellules effectrices de la maladie (Neubert 2008). Leur utilisation en médecine vétérinaire reste confinée à l’oncologie expérimentale, avec des données toxicologiques limitées chez le chat (thrombocytopénie, neurotoxicité périphérique potentielle).
Les thérapies à base de cellules T régulatrices autologues expansées ex vivo, qui visent à restaurer la tolérance immunologique par transfert adoptif de Treg CD4+CD25+FoxP3+, représentent l’horizon le plus ambitieux de la recherche en immunothérapie des maladies auto-immunes. Les protocoles de tri cellulaire, d’expansion et de réinjection développés chez l’Homme (Bluestone 2015) pourraient théoriquement être adaptés au chat, mais les défis techniques et financiers demeurent considérables, et aucun essai préclinique n’a été initié dans le contexte spécifique de la pododermatite plasmocytaire.
Conclusion
La pododermatite plasmocytaire féline, longtemps considérée comme une curiosité dermatologique anecdotique, s’affirme aujourd’hui comme un modèle clinique fascinant à l’interface de la dermatologie, de l’immunologie et de l’hématologie vétérinaires. La compréhension de cette maladie a progressé de manière substantielle depuis les descriptions princeps de Gruffydd-Jones en 1980, passant d’une entité purement descriptive à un syndrome immunopathologique dont les mécanismes moléculaires — activation plasmocytaire polyclonale, dysrégulation des axes IL-6/STAT3 et BAFF/NF-κB, dépôt de complexes immuns — sont désormais partiellement élucidés. L’arsenal thérapeutique, dominé par la doxycycline et la ciclosporine, offre des taux de réponse satisfaisants dans la majorité des cas, mais le profil récidivant de la maladie et l’hétérogénéité des réponses individuelles soulignent les limites des approches actuelles. Le concept de syndrome plasmocytaire félin systémique, intégrant pododermatite, stomatite plasmocytaire et atteinte rénale, fournit un cadre nosologique cohérent qui devrait guider la recherche future vers une évaluation systématique des manifestations extra-podales et une stratification pronostique fondée sur des biomarqueurs objectifs. L’essor des thérapies ciblées et des approches de médecine régénérative offre des perspectives encourageantes, à condition que la communauté vétérinaire se dote d’études prospectives multicentriques et de registres de cas permettant d’atteindre la puissance statistique nécessaire à la validation de ces innovations.
Bibliographie
Arzi B, Murphy B, Cox DP, Vapniarsky N, Kass PH, Verstraete FJ. Presence and quantification of mast cells in the gingiva of cats with tooth resorption, periodontitis and chronic stomatitis. Arch Oral Biol. 2010;55:148-154.
Backel KA, Cain CL, Mauldin EA. Canine and feline plasma cell pododermatitis: retrospective analysis of clinical and histopathologic findings. Vet Dermatol. 2013;24:404.
Bettenay SV, Mueller RS, Dow K, Friend S. Prospective study of the treatment of feline plasmacytic pododermatitis with doxycycline. Vet Rec. 2003;152:564-566.
Bluestone JA, Buckner JH, Fitch M, Gitelman SE, Gupta S, Helber MK. Type 1 diabetes immunotherapy using polyclonal regulatory T cells. Sci Transl Med. 2015;7:315ra189.
Bradwell AR, Carr-Smith HD, Mead GP, Tang LX, Showell PJ, Drayson MT, Drew R. Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clin Chem. 2001;47:673-680.
Cain DW, Cidlowski JA. Immune regulation by glucocorticoids. Nat Rev Immunol. 2017;17:233-247.
Center SA, Smith CA, Wilkinson E, Erb HN, Lewis RM. Clinicopathologic, renal immunofluorescent, and light microscopic features of glomerulonephritis in the dog. J Am Vet Med Assoc. 1990;190:81-90.
de Mari K, Maynard L, Eun HM, Lebreux B. Treatment of canine parvoviral enteritis with interferon-omega in a placebo-controlled field trial. Vet Rec. 2004;152:105-108.
DiBartola SP, Tarr MJ, Webb DM, Giger U. Familial renal amyloidosis in Chinese Shar-Pei dogs. J Am Vet Med Assoc. 1997;197:483-487.
Furie R, Petri M, Zamani O, Cervera R, Wallace DJ, Tegzová D. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63:3918-3930.
German AJ, Cannon MJ, Dye C, Booth MJ, Pearson GR, Reay CA. Oesophageal strictures in cats associated with doxycycline therapy. J Feline Med Surg. 2005;7:33-41.
Gonzales AJ, Bowman JW, Fici GJ, Zhang M, Mann DW, Mitton-Fry M. Oclacitinib (APOQUEL) is a novel Janus kinase inhibitor with activity against cytokines involved in allergy. J Vet Pharmacol Ther. 2014;37:317-324.
Groux H, O’Garra A, Bigler M, Rouleau M, Antonenko S, de Vries JE. A CD4+ T-cell subset inhibits antigen-specific T-cell responses and prevents colitis. Nature. 1997;389:737-742.
Gruffydd-Jones TJ, Orr CM, Lucke VM. Foot pad swelling and ulceration in cats: a report of five cases. J Small Anim Pract. 1980;21:31-40.
Guaguère E, Bensignor E. Pododermatite plasmocytaire féline. Prat Méd Chir Anim Comp. 2004;39:29-36.
Harley R, Gruffydd-Jones TJ, Day MJ. Immunohistochemical characterization of oral mucosal lesions in cats with chronic gingivostomatitis. J Comp Pathol. 2003;128:147-160.
Kishimoto T. Interleukin-6: from basic science to medicine — 40 years in immunology. Annu Rev Immunol. 2005;23:1-21.
Last RD, Suzuki Y, Manning T, Lindsay D, Galipeau L, Bhopale V. A case of fatal systemic toxoplasmosis in a cat being treated with cyclosporin A for feline atopy. Vet Dermatol. 2004;15:194-198.
Latimer KS. Duncan and Prasse’s Veterinary Laboratory Medicine: Clinical Pathology. 5th ed. Wiley-Blackwell; 2014.
Lowe AD, Campbell KL, Graves TK. Glucocorticoids in the cat. Vet Dermatol. 2008;19:340-347.
Mackay F, Schneider P. Cracking the BAFF code. Nat Rev Immunol. 2009;9:491-502.
Mellor PJ, Haugland S, Smith KC, Powell RM, Gaskell RM, Knottenbelt CM, Argyle DJ. Histopathologic, immunohistochemical, and cytologic analysis of feline myeloma-related disorders: further evidence for primary extramedullary development in the cat. Vet Pathol. 2006;43:234-246.
Neubert K, Meister S, Moser K, Tolber C, Peddinghaus A, Nimmerjahn F, Schett G, Voll RE. The proteasome inhibitor bortezomib depletes plasma cells and protects mice with lupus-like disease from nephritis. Nat Med. 2008;14:748-755.
Niimi A, Torigoe R, Sato M. Immunomodulatory effects of tetracyclines on human T-lymphocyte proliferative response. Clin Exp Immunol. 1998;111:328-332.
Ortalda C, Noli C, Colombo S, Borio S. Oclacitinib in feline nonflea-, nonfood-induced hypersensitivity dermatitis: results of a small prospective pilot study of client-owned cats. Vet Dermatol. 2015;26:235-e52.
Quimby JM, Webb TL, Habenicht LM, Dow SW. Safety and efficacy of intravenous infusion of allogeneic cryopreserved mesenchymal stem cells for treatment of chronic kidney disease in cats: results of three sequential pilot studies. Stem Cell Res Ther. 2013;4:48.
Roberts ES, Speranza C, Friberg C, Griffin C, Steffan J, Roycroft L, Alva R. Confirmatory field study for the effectiveness and safety of cyclosporine in the control of feline hypersensitivity dermatitis. J Vet Pharmacol Ther. 2016;39:487-493.
Robson D, Burton G. Cyclosporin: applications in small animal dermatology. Vet Dermatol. 2003;14:1-9.
Sapadin AN, Fleischmajer R. Tetracyclines: nonantibiotic properties and their clinical implications. J Am Acad Dermatol. 2006;54:258-265.
Scarampella F, Ordeix L. Doxycycline therapy in 10 cases of feline plasma cell pododermatitis: clinical, haematological and serological evaluations. Vet Dermatol. 2018;29:467-e158.
Tasca S, Carli E, Caldin M, Menegazzo L, Furlanello T, Solano-Gallego L. Serum free light chain concentrations in dogs and cats with various diseases. Vet Clin Pathol. 2018;47:419-427.
Taylor JE, Schmeitzel LP. Plasma cell pododermatitis with chronic footpad hemorrhage in two cats. J Am Vet Med Assoc. 2004;197:375-377.
Werner AH, Gruendl S, Geisweid K, Mueller RS. Clonality testing in feline lymphoma by PCR for antigen receptor rearrangement (PARR). Vet Immunol Immunopathol. 2011;143:181-186.
White SD, Rosychuk RAW, Janik TA, Denerolle P, Schultheiss P. Plasma cell stomatitis-pharyngitis in cats: 40 cases (1973-1991). J Am Vet Med Assoc. 2000;200:1377-1380.