Les levures du genre Malassezia constituent des agents fongiques lipophiles ayant évolué comme commensaux cutanés et pathogènes opportunistes chez diverses espèces de mammifères et d’oiseaux. Leur implication dans les affections dermatologiques et otologiques canines et félines représente un défi clinique quotidien pour les praticiens vétérinaires à l’échelle mondiale. Lors du dernier congrès NAVDF à Orlando, notre confrère Ross Bond, spécialiste mondial sur le sujet, a eu l’occasion de faire un point complet, tant pathogénique que diagnostique et thérapeutique.
Historique et taxonomie des levures Malassezia
L’association entre les levures Malassezia et l’otite externe canine remonte aux travaux pionniers de Bengt Gustafson, qui publia en 1955 sa thèse à Stockholm portant sur 201 cas d’otite externe principalement aiguë chez le chien. Le Cocker Spaniel constituait la race la plus représentée dans cette étude, et il demeure remarquable que cette prédisposition raciale soit encore reconnaissable dans la pratique clinique contemporaine. Gustafson isola des levures seules dans 108 cas et des levures associées à des staphylocoques dans la majorité des cas restants, une observation que les praticiens effectuant quotidiennement de la cytologie reconnaîtront immédiatement comme familière.
Il observa que la fréquence des levures diminuait dans les cas chroniques, laissant place à des infections à Proteus et Pseudomonas, constatation avec laquelle la communauté vétérinaire contemporaine serait unanimement d’accord. Sur 97 oreilles saines examinées, il ne détecta qu’une faible croissance levurienne dans huit cas seulement. Les caractéristiques morphologiques de ces levures — forme ovale, bourgeonnement polaire, absence de mycélium, croissance lente et absence de fermentation — conduisirent Gustafson à les rattacher au genre Pityrosporum, aujourd’hui dénommé Malassezia. Après consultation du Bureau Central des Cultures Fongiques aux Pays-Bas, et face à l’absence de souche de référence disponible (l’isolat de rhinocéros des années 1930 ayant disparu), il proposa temporairement l’appellation Pityrosporum canis.
Ses expérimentations démontrèrent qu’une inoculation de cette levure chez des chiens sains induisait une otite transitoire légère, et que l’application de gélose maltée additionnée d’huile d’olive dans le conduit auditif favorisait la prolifération de Malassezia et l’apparition d’une otite. Ces observations permirent à Gustafson de conclure que Pityrosporum canis représentait une cause d’otite et que cette affection pouvait survenir par activation de levures résidant normalement dans le conduit auditif externe.
Soixante-dix ans plus tard, le consensus scientifique confirme pleinement que M. pachydermatis constitue un pathogène otique opportuniste secondaire nécessitant une forme de prédisposition ou une anomalie auriculaire préexistante pour générer une otite cliniquement significative. Le Dr Gustafson avait donc correctement identifié les mécanismes fondamentaux de cette pathologie dès le milieu du vingtième siècle.
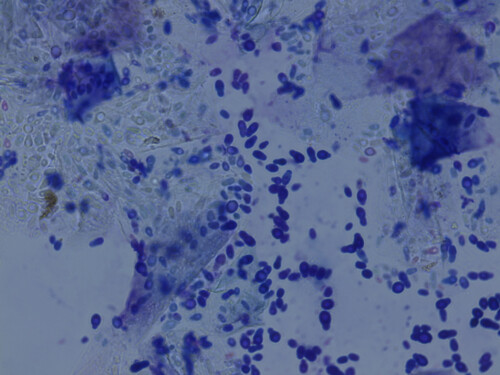
Aspect classique de Malassezia pachydermatis
Historique de la dermatite à Malassezia
En ce qui concerne la dermatite à Malassezia chez le chien, les premiers rapports sont attribués au praticien belge Dufait, qui publia plusieurs articles à la fin des années 1970 et au début des années 1980 décrivant cette affection. Le professeur Larson au Brésil contribua également par la publication de séries de cas documentant les manifestations cliniques de cette pathologie émergente. Ken Mason reprit ensuite le flambeau en présentant ces observations lors de diverses réunions scientifiques et conférences professionnelles. La première mention de dermatite à Malassezia lors d’un congrès de l’AAVD/NAVDF remonte probablement à 1987 à Phoenix, Arizona, où Ken Mason présenta un résumé décrivant trois cas canins.
Reconnaissance et acceptation clinique
Cette présentation initiale suscita une réception mitigée au sein de la communauté scientifique, certains praticiens demeurant sceptiques quant à la pertinence pathogénique de cette levure dans le contexte dermatologique. L’acceptation progressive de la pertinence clinique de cette levure s’ensuivit, et la dermatite à Malassezia fait désormais partie intégrante de la pratique vétérinaire quotidienne en médecine des petits animaux à l’échelle mondiale.
Évolution taxonomique et complexité du genre
Origines de la nomenclature
Le genre Malassezia fut observé pour la première fois en 1846 et initialement dénommé Cryptococcus. Malassez décrivit ensuite ces spores dans les cellules de pellicules humaines, établissant ainsi le lien entre ces organismes et les affections desquamatives du cuir chevelu humain. Le nom de genre Malassezia fut proposé en reconnaissance des travaux de ce chercheur, puis modifié par Sabouraud en Pityrosporum, avant d’être rétabli dans les années 1980 dans sa dénomination originelle.
Classification lipidique et morphologique
La taxonomie initiale était relativement simple et compréhensible : toutes les levures Malassezia étaient reconnues comme lipophiles, et celles strictement dépendantes des lipides, nécessitant des milieux de culture spéciaux supplémentés en substances grasses, étaient regroupées sous l’espèce unique Malassezia furfur. Les mycologues éminents de l’époque, tels qu’Evelyn Guého et Gillian Midgley, soulignaient cependant l’existence d’une grande diversité morphologique au sein de ce groupe, distinguant différentes formes ovales désignées comme forme ovale 1, forme ovale 2, forme ovale 3, et ainsi de suite. La diversité morphologique suggérait fortement l’existence de multiples espèces distinctes au sein de ce regroupement taxonomique initialement considéré comme monospécifique.
Spécificités de Malassezia pachydermatis
Malassezia pachydermatis, l’espèce prédominante chez les carnivores et sans doute la plus pertinente pour la pratique vétérinaire, était classée comme non-dépendante des lipides car capable de croître sur gélose Sabouraud Dextrose, le milieu de culture mycologique de routine. Les espèces lipophiles humaines démontrent leur importance clinique dans diverses affections dermatologiques telles que le Pityriasis versicolor, caractérisé en cytologie par l’aspect classique de “spaghettis et boulettes de viande” de la phase pseudohyphale de ce qui était autrefois dénommé M. orbiculare, ainsi que dans la dermatite séborrhéique du cuir chevelu.
Apport de la mycologie moléculaire
L’avènement des techniques de mycologie moléculaire a considérablement complexifié la taxonomie du genre. Le séquençage complet du génome de M. pachydermatis révéla qu’elle appartient en réalité au groupe strictement lipodépendant, car elle partage avec les autres espèces l’absence du gène codant pour la synthase des acides gras. Sa capacité apparemment paradoxale à croître sur gélose Sabouraud s’explique par la présence suffisante d’acide palmitique dans le composant peptone de ce milieu, quantité adéquate pour supporter la croissance de cette espèce mais insuffisante pour les autres espèces plus exigeantes. Les autres espèces nécessitent une supplémentation lipidique marquée et substantielle pour leur culture en laboratoire.
Espèces félines et diversité animale
Chez les chats, diverses espèces strictement lipophiles ont été isolées en culture avec confirmation moléculaire subséquente de l’identification des colonies, notamment M. sympodialis, M. globosa, M. furfur, M. nana (particulièrement dans le conduit auditif) et M. slooffiae (notamment au niveau des replis unguéaux). Rui Kano fut le premier à décrire M. nana chez les chats et les bovins, établissant ainsi l’importance de cette espèce dans ces populations animales. D’autres espèces sont principalement associées à la peau humaine en culture, tandis que certaines sont liées à des hôtes animaux spécifiques : M. caprae chez les chèvres, M. equina chez les chevaux, M. gallinae chez les poulets, et M. botryllophilus chez les chauves-souris. La distinction entre ces espèces ne peut s’effectuer uniquement par culture ; un test moléculaire de séquençage demeure nécessaire pour une identification précise et définitive. Cette complexité taxonomique croissante soulève des questions importantes concernant la pertinence clinique de cette diversité d’espèces. La capacité à identifier précisément l’espèce impliquée dans un cas clinique donné pourrait potentiellement influencer les décisions thérapeutiques, particulièrement dans le contexte de l’émergence de la résistance aux antifongiques.
Écologie cutanée et distribution anatomique
Mécanisme de la pathogénicité
La transition d’un statut commensal à celui de pathogène s’observe fréquemment lorsque l’équilibre homéostatique entre l’immunité de l’hôte et la virulence fongique se trouve perturbé, nécessitant une approche thérapeutique ciblée associée à l’identification et la correction des facteurs prédisposants sous-jacents.
Colonisation commensale chez le chien
Malassezia pachydermatis constitue un habitant normal de la peau et des muqueuses saines du chien, faisant partie intégrante du microbiome cutané commensal. Une étude portant sur 40 chiens sains réalisée il y a de nombreuses années révéla une fréquence d’isolement en culture supérieure à 30% au niveau du conduit auditif, confirmant que cette localisation anatomique représente un réservoir majeur de colonisation commensale. En revanche, l’aisselle, l’aine et le dos présentaient un taux d’isolement inférieur ou égal à 10%, suggérant une colonisation beaucoup plus sporadique et limitée de ces sites. Pour détecter cette levure sur la peau d’un animal sain par méthode culturale, les sites de prédilection sont l’espace interdigité et la région des lèvres, où les taux de récupération en culture s’avèrent significativement supérieurs. Parmi les sites muqueux, l’anus représente la localisation privilégiée, avec plus de 50% des animaux présentant une colonisation anale détectable par culture. Une étude temporelle avec prélèvements hebdomadaires confirma que l’anus demeure le site où la levure persiste de manière la plus constante au fil du temps, les autres sites montrant une colonisation plus intermittente et variable.
Présence dans le tractus gastro-intestinal
Des observations inattendues et initialement surprenantes ont émergé concernant la présence de Malassezia dans le tractus gastro-intestinal. Une étude ultérieure menée en collaboration avec Arti Kathrani, interniste spécialisée, et Bart Theelen, travaillant à l’époque à l’Institut de Biodiversité Fongique Westerdijk aux Pays-Bas (actuellement au Minnesota), portant sur 45 chiens atteints d’entéropathie et subissant une endoscopie pour diverses investigations diagnostiques, permit de cultiver Malassezia chez huit d’entre eux, confirmant les observations préliminaires et établissant la présence authentique de ces levures dans l’intestin grêle canin.
Microbiome cutané et diversité des espèces
Les études de microbiome utilisant des techniques moléculaires ont révélé une diversité inattendue d’espèces de Malassezia sur la peau canine, notamment par détection d’ADN. Richard Harvey, clinicien et chercheur réputé, publia récemment une étude de microbiome réalisée en collaboration avec certains exposants présents dans l’exposition commerciale de conférences vétérinaires. Une étude examinant la région ombilicale de 20 chiens sains identifia Cladosporium chez tous les individus et M. pachydermatis chez deux d’entre eux seulement, confirmant les résultats des études culturales classiques antérieures. En revanche, de l’ADN de M. sympodialis, M. restricta, M. slooffiae et M. arunalii fut également détecté par méthodes moléculaires. Ces observations contrastent de manière frappante avec les résultats de culture, constituant une observation particulièrement intrigante et scientifiquement troublante. Sur 31 années de culture systématique de Malassezia à partir de peau canine sur milieux supplémentés en lipides conçus théoriquement pour supporter la croissance de toutes les espèces de Malassezia, une seule occasion permit d’isoler autre chose que M. pachydermatis. De même, dans l’étude intestinale mentionnée précédemment, M. sympodialis fut cultivée une seule fois sur l’ensemble des échantillons.
Hypothèses sur la divergence Moléculaire/Culture
Cette divergence stupéfiante entre détection moléculaire et culture soulève plusieurs hypothèses explicatives fondamentales : les milieux de culture pourraient ne pas être optimaux pour toutes les espèces lipophiles exigeantes malgré les supplémentations lipidiques appliquées, ces espèces pourraient être présentes en faibles nombres sous le seuil de détection culturale rendant leur isolement peu probable, des microcolonies mixtes pourraient exister avec persistance préférentielle de M. pachydermatis lors des repiquages successifs conduisant à la perte des autres espèces plus fragiles, ou l’ADN détecté pourrait ne pas correspondre à des organismes viables mais plutôt à du matériel génétique provenant de cellules mortes ou endommagées. Une contamination de la peau canine par de l’ADN de Malassezia humaine transféré par manipulation et contact demeure également envisageable, particulièrement dans un contexte où les interactions homme-animal sont fréquentes et intimes.
Observations environnementales
Une découverte récente particulièrement surprenante provient d’une étude publiée concernant les feuilles de vigne de vignobles italiens, où Cladosporium et Malassezia furent identifiés comme les champignons les plus abondants dans ce substrat végétal. Cette observation s’avère inhabituelle car Malassezia n’est généralement pas considérée comme un organisme végétal mais plutôt comme un habitant obligatoire de la peau des mammifères, soulevant des questions intrigantes concernant l’écologie globale de ce genre fongique.
Microbiome et dermatite atopique
Cody Meason Smith, mycologue éminente travaillant en collaboration avec le Dr Hoffman, publia un éventail remarquable d’études sur le microbiome cutané canin. Chez les chiens de laboratoire en bonne santé, les analyses moléculaires montrent que M. restricta et M. globosa prédominent, exactement comme dans la peau humaine saine. En revanche, chez les chiens de laboratoire subissant des poussées de dermatite atopique canine expérimentalement induites, M. pachydermatis et M. restricta deviennent les plus abondantes dans les analyses moléculaires, avec détection en arrière-plan d’espèces plus strictement lipophiles également.
La question de Malassezia globosa
Cette observation concernant M. globosa soulève des interrogations cliniques importantes. M. globosa présente une morphologie sphérique caractéristique avec un bourgeonnement épais et proéminent, distincte du bourgeon étroit observé chez certaines espèces de Candida. Bien que des levures rondes soient parfois observées en cytologie, notamment d’origine auriculaire, elles ne correspondent pas aux observations cytologiques de routine dans la majorité des cliniques vétérinaires. La question demeure donc : si M. globosa est importante et présente selon les études moléculaires, pourquoi ne l’observe-t-on pas en cytologie de routine ?
Limites des cultures et contamination
Plusieurs explications peuvent être proposées pour cette discordance apparente. Les milieux de culture actuels, même ceux enrichis en lipides comme l’agar Dixon modifié, pourraient ne pas être suffisamment optimaux pour cultiver toutes ces diverses espèces de Malassezia aux exigences nutritionnelles strictes et variées. Ces espèces pourraient être présentes en nombre insuffisant, en dessous du seuil de détection par culture traditionnelle, ne générant pas suffisamment de colonies pour être remarquées. Le phénomène de microcolonies mixtes constitue une autre explication plausible. Lors des repiquages successifs de colonies mixtes, M. pachydermatis, espèce facile à cultiver et à croissance rapide, pourrait persister tandis que les espèces lipophiles plus exigeantes et à croissance lente pourraient progressivement mourir et disparaître. L’ADN moléculaire détecté indique la présence d’ADN mais ne confirme pas nécessairement la présence d’organismes viables et métaboliquement actifs. Du matériel génétique provenant de cellules mortes ou dégradées pourrait persister dans l’environnement cutané et être détecté par amplification PCR. La contamination de la peau canine par de l’ADN de Malassezia humaine transféré par manipulation, caresses et contacts étroits entre propriétaires et animaux pourrait également contribuer à certains des résultats moléculaires observés. Des problèmes techniques méthodologiques dans les études de microbiome, bien qu’en dehors du domaine d’expertise dermatologique, pourraient également influencer les résultats et leur interprétation.
Influence climatique
Les levures Malassezia résident dans le stratum corneum, au niveau de ce que Bart Theelen, mycologue éminent, appellerait la zone du manteau transitionnel, où elles subissent l’influence de facteurs climatiques tels que la chaleur et l’humidité environnementales. La pratique dermatologique à Londres, située à 4 400 miles au nord-est de la localisation de cette conférence, s’effectue dans un climat beaucoup plus frais et beaucoup moins humide que de nombreuses régions nord-américaines. L’incubateur de laboratoire mycologique fonctionne comme un incubateur humide à 32 degrés Celsius, reproduisant les conditions optimales pour la croissance levurienne. De nombreux chiens dans le monde vivent dans des environnements humides et chauds, soit toute l’année dans les régions tropicales et subtropicales, soit durant les mois d’été dans les régions tempérées. Les chiens vivant dans de telles conditions climatiques, particulièrement ceux du sud-est des États-Unis, présentent une fréquence accrue de prolifération de Malassezia selon les rapports de praticiens exerçant dans différentes zones géographiques et climatiques.
Interactions avec l’hôte et les bactéries
Les levures dans le stratum corneum sont influencées par la chimie de l’hôte et les facteurs immunitaires au sens large, incluant l’immunité innée et adaptative. Elles métabolisent les lipides sébacés produits par les glandes sébacées et les lipides dérivés des kératinocytes, substrats abondants dans le stratum corneum en raison de leur nécessité pour le métabolisme levurien lipodépendant. Leurs interactions avec les bactéries cutanées commensales et pathogènes demeurent mal comprises et constituent un domaine nécessitant des recherches approfondies. Une publication récente indiquait que certaines espèces lipophiles de Malassezia présentes sur la peau humaine interagissent avec Staphylococcus aureus et réduisent sa tendance à la formation de biofilm, suggérant un rôle potentiellement bénéfique dans la régulation de la virulence bactérienne et la modulation de l’écologie microbienne cutanée. Ces levures commensales pourraient donc exercer des effets protecteurs en limitant la pathogénicité d’autres microorganismes cutanés, ajoutant une complexité supplémentaire à notre compréhension de l’écologie microbienne cutanée.
Pathogenèse et mécanismes de virulence
Production enzymatique et activité métabolique
Les champignons, organismes nutritionnellement absorptifs, libèrent un large éventail d’enzymes dans leur environnement pour créer des substrats assimilables par la cellule fongique à travers la paroi cellulaire et la membrane cellulaire. Ces enzymes, particulièrement lors de proliférations levuriennes marquées et massives, possèdent le potentiel d’endommager les cellules épidermiques de l’hôte et d’activer les systèmes immunitaires innés et spécifiques. La paroi cellulaire de Malassezia contient des molécules d’adhésion facilitant l’adhérence aux squames cornéennes, un processus pouvant être quantifié en passant des semaines à compter microscopiquement les cellules de Malassezia pour déterminer si elles adhèrent aux squames ou non et à examiner les facteurs moléculaires impliqués dans ce processus. Ces levures présentent des épitopes de liaison aux IgE responsables de réactions d’hypersensibilité immédiate et des motifs moléculaires associés aux pathogènes (PAMPs), reconnus par les cellules immunitaires via des récepteurs de lectine de type C, ainsi que par les cellules T helper 17. L’importance croissante des lymphocytes T helper 17 dans l’immunité fongique, tant innée qu’adaptative, est de plus en plus documentée dans la littérature scientifique contemporaine, bien que les mécanismes immunologiques détaillés dépassent le domaine d’expertise dermatologique et nécessitent consultation de la littérature spécialisée en immunologie pour une compréhension approfondie.
Lipases et biochimie cutanée
En médecine humaine, les lipases fongiques jouent un rôle reconnu et bien établi dans le développement des pellicules et de la dermatite séborrhéique du cuir chevelu. Aristea Velegraki et ses collaborateurs ont démontré que la lipoperoxydation du squalène génère des métabolites reconnus comme marqueurs biochimiques de la peau pelliculaire, potentiellement impliqués dans la pathogenèse de cette affection. Toutefois, le squalène ne représente pas un composant majeur du sébum canin, contrairement au sébum humain où il constitue une fraction lipidique substantielle.
Caractérisation enzymatique et phospholipases
Des kits commerciaux tels qu’API Zym permettent de caractériser les activités enzymatiques du surnageant de culture et du culot cellulaire d’une culture en bouillon. Après centrifugation du culot cellulaire d’une culture en bouillon, les activités enzymatiques peuvent être détectées dans le kit de test. Certaines enzymes apparaissent associées au culot cellulaire plutôt qu’au surnageant, tandis que d’autres sont plus abondantes dans le surnageant que dans la cellule, et certaines présentent des niveaux équivalents dans les deux fractions. M. pachydermatis produit toute une gamme d’enzymes, incluant estérases et lipases. La production de phospholipase s’avère particulièrement importante chez M. pachydermatis, avec des niveaux plus élevés dans les souches associées à la peau lésionnelle comparativement aux isolats de peau saine, et dans certains génotypes davantage associés aux affections cutanées qu’à la colonisation commensale.
Virulence et expression protéique
La regrettée Claudia Cafarchia, malheureusement décédée récemment, et son groupe de recherche ont démontré l’importance de la production de phospholipase, montrant des niveaux enzymatiques supérieurs dans les souches pathogènes. L’administration d’azolés, médicaments fongistatiques, perturbe la production enzymatique levurienne, tout comme les huiles essentielles selon certaines publications. Une prolifération importante de Malassezia génère donc une production enzymatique massive potentiellement impliquée dans la pathogenèse de la dermatite et de l’otite. Des travaux récents impliquant Thomas Dawson et divers collaborateurs ont souligné l’importance d’étudier l’expression des protéines fongiques dans des environnements physiologiquement pertinents plutôt que dans des conditions artificielles de laboratoire. Une culture en bouillon ne reproduit pas les conditions physiologiques du stratum corneum, et l’expression protéique des levures dans ce milieu naturel diffère substantiellement de celle obtenue en bouillon artificiel. Ces auteurs ont développé des techniques scientifiques sophistiquées pour démontrer l’expression protéique des levures directement dans le stratum corneum, révélant des profils d’expression différents de ceux observés en culture liquide.
Expérimentations animales et transition commensal-pathogène
Des expérimentations sur beagles de laboratoire ont montré qu’une application quotidienne de Malassezia sur la peau sous occlusion pendant une semaine permettait de créer une plaque locale de dermatite avec exsudat graisseux brun emmêlant les poils, similaire aux lésions observées en clinique courante. Toutefois, l’arrêt de l’application conduisait à une guérison complète en une semaine, démontrant que la peau normale contrôle donc efficacement sa population de Malassezia et ne développe pas d’infection par simple application externe. Ces travaux furent réalisés dans le cadre du Home Office Scientific Procedures Act, législation britannique rigoureuse régulant l’utilisation des animaux dans un environnement scientifique expérimental et garantissant le bien-être animal. Une altération sous-jacente s’avère nécessaire pour permettre la prolifération levurienne pathologique et le développement de signes cliniques. Comme les cliniciens le reconnaissent et le comprennent bien, la peau normale ne s’infecte pas simplement par application de levures. Quelque chose doit être altéré fondamentalement pour permettre à cette levure commensale de proliférer de manière opportuniste et de générer une maladie cliniquement significative.
Facteurs prédisposants et affections sous-jacentes
Diversité des facteurs déclenchants
Les directives consensuelles ont établi une liste des facteurs prédisposants incluant la race, l’allergie, les défauts de desquamation, les endocrinopathies, les plis cutanés, le climat et les cas non identifiés. Cette liste comporte des implications cliniques majeures nécessitant une compréhension approfondie. Dans les cas non identifiés, représentant la catégorie la plus frustrante, l’absence de compréhension du facteur déclenchant initial empêche toute correction et conduit inévitablement à une maladie chronique récurrente et récidivante, générant frustration intense chez le propriétaire et nécessité de traitements continus et répétés sans résolution définitive.
Gestion des allergies
En présence d’allergie comme facteur prédisposant, l’élimination complète des levures par un antifongique, aussi efficace soit-il et même le meilleur médicament antifongique connu des humains, ne supprime pas les signes allergiques résiduels persistants. Si l’unique critère de succès thérapeutique pour le propriétaire est la disparition complète de l’érythème et du prurit, l’échec à court terme est inévitable et prévisible, sauf si le propriétaire est correctement informé de manière transparente de la réponse partielle attendue dans ces circonstances particulières. Le chien Westie Highland White Terrier classique hors de contrôle avec les médicaments conventionnels illustre parfaitement cette situation : le traitement de Malassezia et des staphylocoques révèle une dermatite atopique sous-jacente qui devient alors contrôlable avec des thérapies appropriées. Les défauts primaires de cornification constituent une condition permanente et irréversible. Le chien possède intrinsèquement ce trouble de kératinisation et en demeure affecté de manière continue. Les plis cutanés persistent sauf intervention diététique permettant leur réduction par perte de poids substantielle ou résection chirurgicale définitive. Si les animaux présentent des plis anatomiques, alors ces plis persistent indéfiniment à moins d’être rendus plus petits par modification pondérale ou enlevés chirurgicalement. Les brachycéphales constituent également une catégorie particulièrement à risque, notamment au Royaume-Uni, où la prévalence du Bouledogue Français a fortement augmenté.

Le Basset Hound est fréquemment concerné par les dermatites à Malassezia
Dermatite atopique et troubles de la kératinisation
L’allergie, particulièrement la dermatite atopique, constitue le facteur déclenchant prédominant dans de nombreux hôpitaux vétérinaires. Dans certains hôpitaux spécialisés, 50% des cas de dermatite à Malassezia présentent une dermatite atopique comme déclencheur sous-jacent probable. Une étude utilisant des plaques de contact comme méthode de culture réalisée par des étudiants dans le cadre d’un projet de recherche démontra que les animaux sains présentaient une faible fréquence d’isolement et de très faibles populations de Malassezia, tandis que les atopiques montraient une fréquence d’isolement et des populations significativement plus élevées sur le plan statistique. La colonne verte-bleuâtre représentant les animaux sains sur le graphique montre une faible fréquence et de très faibles populations, tandis que les atopiques en rouge démontrent des isolements beaucoup plus fréquents et des populations considérablement plus élevées également.
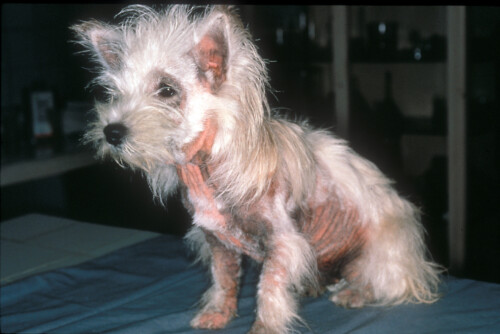
Westie atopique présentant une dermatite à Malassezia
Complications de la dermatite atopique
Les chiens atopiques compliqués ne présentent pas simplement une dermatite atopique pure et simple. Dans de nombreux cas, il existe également une dermatite secondaire à Malassezia qui aggrave considérablement la sévérité clinique globale. Environ deux tiers des chiens atopiques développent des problèmes de pyodermite superficielle et un tiers développe un problème de dermatite à Malassezia. Elizabeth Molterdin et ses collègues ont publié une très belle étude remarquable dans Veterinary Pathology il y a quelques années, faisant référence à l’ichtyose congénitale autosomique récessive observée chez les Bouledogues Américains. Cette étude démontre élégamment que les chiots squameux affectés par ce trouble de kératinisation génétique deviennent érythémateux et prurigineux lorsqu’ils sont colonisés par Malassezia, contrairement aux chiots sains non affectés qui ne développent pas de signes cliniques malgré une exposition similaire. Le trouble de la desquamation affecte donc l’épiderme de manière à favoriser la prolifération opportuniste de Malassezia et l’apparition de signes cliniques d’inflammation et de prurit.
Prédisposition raciale et anatomique
Certaines races présentent une prédisposition particulière marquée à la dermatite à Malassezia. Le Basset Hound séborrhéique constitue l’exemple paradigmatique, montrant une densité de population médiane de Malassezia dans l’aisselle de l’ordre de 10^5, soit 100 000 fois supérieure à celle des chiens de race mixte sains utilisés comme groupe contrôle. Les Basset Hounds sains présentent des populations intermédiaires, avec un chevauchement substantiel entre individus sains et malades sur les graphiques de distribution. Une quantité substantielle de Malassezia peut donc être présente sur une peau d’apparence cliniquement normale, selon les enzymes produites par les levures et la réactivité immunologique cutanée de l’hôte.
Les ars sont fréquememnt concernés par la dermatite à Malassezia
Prédisposition féline (Devon Rex, Sphinx)
Chez les chats, le Devon Rex se comporte comme le Basset Hound dans le monde félin, représentant l’équivalent félin de cette race canine prédisposée. Ces chats présentent une susceptibilité marquée à Malassezia. Une étude sur plaque de contact dans l’aisselle des chats démontre que les chats de gouttière ne présentent pas beaucoup de Malassezia, les Cornish Rex ne présentent pas de Malassezia, tandis que les Devon Rex séborrhéiques avec dépôt séborrhéique noir montrent une croissance sur la plaque de contact. Les Devon Rex sains constituent un groupe intermédiaire entre ces extrêmes. Les chats Sphinx, étroitement apparentés génétiquement aux Devon Rex mais dépourvus de pelage, développent fréquemment une otite à Malassezia précocement dans leur vie, souvent dès le jeune âge.
Zones anatomiques à risque
Les plis cutanés constituent des zones de prédilection anatomique pour la prolifération de Malassezia. Le pli ombilical des Basset Hounds femelles entières représente une localisation fréquemment affectée, montrant souvent un matériau adhérent aux tiges pilaires. Les plis faciaux des brachycéphales, notamment les Bouledogues Français dont la prévalence a explosé au Royaume-Uni et en Amérique du Nord, représentent des localisations fréquentes de dermatite à Malassezia. Bien que cette situation constitue un désastre pour le bien-être animal en raison des multiples problèmes de santé affectant ces races brachycéphales extrêmes, elle assure paradoxalement la viabilité financière de nombreuses cliniques vétérinaires en générant un volume important de consultations et de traitements.
Otite à Malassezia : pathogénie et écologie microbienne
Transition de la flore commensale à pathogène
Dans le contexte de l’otite, Malassezia agit comme pathogène secondaire opportuniste, et le schéma conceptuel de l’otite distinguant facteurs de prédisposition, primaires, secondaires et perpétuants s’avère très utile pour délimiter tous les éléments expliquant les cas otologiques problématiques et réfractaires.
Analyse quantitative de la flore auriculaire
Des données provenant de VP Hwang, l’un des anciens doctorants de Peter Hill, montrent la fréquence d’isolement de diverses espèces microbiennes dans l’otite par culture quantitative. Les corynéformes, les staphylocoques à coagulase négative et les microcoques présents chez les animaux sains disparaissent progressivement dans les cas d’otite, alors que simultanément s’observe une transition vers des infections à staphylocoques à coagulase positive et bacilles Gram négatif tels que Proteus et Pseudomonas et organismes similaires. Dans l’étude de Hwee Peng Hwang, il existait une fréquence assez élevée d’isolement de Malassezia chez les animaux normaux, environ 25%, bien que parfois des taux inférieurs soient rapportés dans d’autres études. Gustafson dans son travail original rapportait des fréquences inférieures à ce pourcentage. Une petite augmentation de fréquence s’observe dans les cas d’otite comparativement aux animaux sains. L’analyse quantitative révèle cependant une différence majeure et fondamentale concernant la taille des populations levuriennes. Vingt chiens sains examinés par méthode semi-quantitative de lavage par écouvillonnage montrèrent deux chiens avec une seule colonie de Malassezia et 18 chiens sans Malassezia auriculaire détectable. Les chiens malades issus d’études menées récemment avec des résidents précédents et actuels présentent une taille médiane de population de l’ordre de 10^5, représentant une augmentation de 100 000 fois de la densité de population dans les cas d’otite avec prolifération de Malassezia comparativement aux oreilles saines.
Dysbiose iatrogène et conséquences thérapeutiques
Depuis de nombreuses années, on observe qu’une monothérapie antibactérienne puissante, telle que l’enrofloxacine injectable ou la pipéracilline-tazobactam, élimine efficacement Pseudomonas dans les cas réfractaires aux traitements conventionnels, mais crée régulièrement une prolifération de Malassezia, voire occasionnellement de Candida. La pipéracilline, pénicilline de troisième génération possédant une activité étendue contre les organismes Gram négatif, associée au tazobactam qui bloque la pénicillinase comme le clavulanate dans d’autres formulations, permet de résoudre les cas d’otite à Pseudomonas en phase terminale désespérée, mais génère fréquemment une otite à levures subséquente.
Impact des antibiotiques sur la flore
Une étude portant sur 20 chiens en suivi actuellement tente de prévenir cette complication iatrogène. Les données concernant la pipéracilline-tazobactam démontrent des résultats similaires bien qu’encore plus marqués qu’avec l’enrofloxacine injectable, cette dernière étant moins efficace contre Pseudomonas et générant moins fréquemment la dysbiose levurienne subséquente. Ces animaux se portent extrêmement bien cliniquement lorsque administrée la pipéracilline et le tazobactam pour leur otite bactérienne, mais développent régulièrement une prolifération de Malassezia nécessitant un traitement antifongique additionnel.
Manifestations cliniques
Signes dermatologiques chez le chien
Les manifestations cliniques de la dermatite à Malassezia canine sont variées et caractéristiques. Un jeune Scottish Terrier peut débuter son existence avec une dermatite chronique caractérisée par des lésions symétriques au niveau de la cuisse médiale et de l’aine, sous forme de plaques d’alopécie assez bien délimitées. Un Jack Russell Terrier plus avancé dans l’évolution de sa maladie présente une excoriation marquée et une lichénification témoignant de la chronicité et de la persistance du processus inflammatoire.
Les Basset Hounds montrent fréquemment un matériau adhérent aux tiges pilaires au niveau du pli ombilical. Ce matériau brunâtre ou noirâtre se retrouve également dans les espaces interdigités. Cette caractéristique clinique s’avère diagnostiquement utile, car si les chiens atopiques, les chiens infestés par Trombicula (aoûtats) ou atteints de démodécie présentent un érythème interdigité, seuls ceux porteurs de levures ou de staphylocoques développent cette crasse kérato-sébacée caractéristique. Le pli du cou des Basset Hounds très malodorants et inflammés montre des dépôts similaires de matériau kérato-sébacé.
Symptomatologie type : prurit et odeur
Les signes cliniques comprennent prurit, érythème, squames et séborrhée grasse, pigmentation, lichénification, et bien sûr, la mauvaise odeur désagréable caractéristique qui accompagne certains de ces animaux et imprègne les salles de consultation. Une paronychie avec croûtes périunguéales et décoloration unguéale brune peut survenir Parfois, le matériau coloré peut être superficiel et peut être retiré mécaniquement, d’autres fois la tache semble être en quelque sorte imprégnée profondément dans la kératine de la griffe de manière plus permanente. Un prurit du chanfrein inhabituellement frénétique constitue une autre manifestation clinique intrigante.
Particularités félines
Les chats ne sont pas de petits chiens, et cette affirmation fondamentale demeure vraie concernant la dermatite à Malassezia. Les chats allergiques présentant un prurit cervico-facial intense peuvent développer une dermatite à Malassezia, bien que moins fréquemment que les chiens. Le chat Rex représente le Basset Hound du monde félin en termes de prédisposition à Malassezia. Les Devon Rex montrent une susceptibilité marquée, avec présence d’un matériel brunâtre sur l’abdomen et la cuisse médiale, et de crasse noirâtre dans les espaces interdigités et les replis unguéaux. Les chats Sphinx, étroitement apparentés génétiquement aux Devon Rex mais dépourvus de pelage, développent précocement une otite à Malassezia.
Syndromes paranéoplasiques félins
Certains praticiens ont rencontré l’alopécie paranéoplasique pancréatique chez les chats plus âgés, syndrome dramatique et caractéristique. Perte de poids soudaine chez un chat âgé avec apparition soudaine d’une alopécie dramatique, symétrique et complète, parfois accompagnée d’un dépôt noirâtre. Un autre cas illustratif montre la peau brillante associée à la perte de stratum corneum, caractéristique assez distinctive de ce syndrome, et le dépôt brun de la dermatite secondaire à Malassezia.
Dermatite exfoliative et thymome
Un autre chat fut vu par plusieurs résidents spécialisés il y a quelques années. Kathy Bortnick, résidente en dermatologie, préleva quelques plaques de contact pour analyse mycologique. Ce chat présentait une dermatite exfoliative causée par un thymome, tumeur thymique. Les cultures sur plaque de contact montrèrent une croissance de Malassezia. Rob, résident en chirurgie des tissus mous et chirurgien visuel pragmatique, enleva chirurgicalement le thymus. Kathy prescrivit deux bains de shampooing au sulfure de sélénium. Toute la Malassezia disparut complètement. La résection chirurgicale du thymus associée à la thérapie topique simple élimina totalement la prolifération levurienne. Le problème paranéoplasique et le trouble de desquamation étant contrôlés, la dermatite à Malassezia disparut. La différence majeure entre chat et chien réside dans la fréquence d’association avec des affections systémiques graves, notamment des néoplasies viscérales et maladies métaboliques, déclenchant Malassezia comme manifestation nouvelle chez un animal âgé. Cette éventualité nécessite une vigilance particulière et une investigation approfondie lors de l’apparition soudaine de prolifération de Malassezia chez un chat précédemment sain.
Approches diagnostiques
Méthodes de quantification et de détection
La quantification de Malassezia sur la peau et la compréhension de sa pertinence clinique constituent des défis diagnostiques complexes.
Plaque de contact vs Brossage par cupule
Les plaques de contact représentent une méthode simple mais largement sous-utilisée. Elles se fabriquent à partir de couvercles de bouteilles remplis à ras bord de milieu de culture, maintenus dans des boîtes de Pétri stériles pour préserver la stérilité. L’application directe sur une lésion cutanée pendant 10 secondes, suivie d’une incubation de trois jours à température appropriée, permet d’apprécier l’abondance levurienne par observation de la croissance confluente ou parsemée. Pour les chats, des couvercles plus petits de dimensions réduites s’appliquent facilement dans les espaces interdigitaux et autres sites anatomiques restreints. Le brossage par cupule constitue définitivement un outil essentiellement de recherche plutôt que de routine clinique. Cette technique nécessite une peau plate et un patient coopératif, conditions pas toujours réunies en pratique. Une cupule stérile en Téflon contenant 2 ml de sérum physiologique additionné de détergent permet de frotter doucement la peau ciblée. Le liquide aspiré subit des dilutions en série jusqu’à obtention d’un nombre dénombrable de colonies après culture, permettant d’extrapoler une densité de population exprimée en unités formant colonies par centimètre carré. Les levures meurent rapidement dans le sérum physiologique avec détergent, nécessitant un traitement immédiat des échantillons, incompatible avec un envoi postal ou un délai de transport prolongé. Les comptages sur plaques de contact et par brossage en cupule ne sont pas bien corrélés statistiquement. Les comptages par ruban adhésif ne sont pas non plus corrélés avec le brossage par cupule. Un problème méthodologique existe donc. La méthode de référence pour la culture de Malassezia, pourrait-on argumenter, demeure le brossage par cupule en tant qu’étalon-or, mais la pratique clinique quotidienne utilise couramment le ruban adhésif ou des techniques similaires plus pratiques.
Cytologie et interprétation clinique
La technique du ruban adhésif, popularisée par la publication historique de Keddie et Libis dans Sabouraudia, permet de diagnostiquer les microbes résidant dans le stratum corneum. Au Royaume-Uni, le Scotch ou Sellotape Diamond Clear sont couramment utilisés, différentes marques commerciales survivant ou non au processus de coloration selon leur composition. Une méthode pratique présentée par notre confrère, consiste à fixer un bout de ruban adhésif à l’extrémité d’une lame de verre, créant un assemblage manipulable à une main. Cette main peut écarter les espaces interdigités ou écarter le pli labial ou le pli facial, permettant l’insertion de la lame, la récolte des squames, puis une coloration Diff-Quik rapide après enroulement et aplatissement du ruban sur la lame.
Facteurs influençant les comptages
La signification des comptages dépend de multiples facteurs. La méthode d’échantillonnage influence fondamentalement les résultats. Les grattages à sec et l’impression directe ne fournissent généralement pas un transfert suffisant de matériel comparé au ‘tape stripping‘, bien que d’autres praticiens puissent avoir des perspectives différentes. Le site anatomique constitue un facteur majeur. Les comptages sur plaques de contact des lèvres et du pied diffèrent significativement. Il existe davantage de levures dans un pli labial chez un chien sain comparativement à l’espace interdigité. Comment déterminer quel seuil populationnel constitue une prolifération pathologique si la population normale varie substantiellement d’un site anatomique à l’autre ?
Influence de la race sur les populations
La race influence considérablement les populations normales. Les chiens de race mixte sains, présentent peu de levures, et lorsqu’ils en possèdent, les populations demeurent très faibles. Les Basset Hounds séborrhéiques montrent une densité de population médiane beaucoup plus élevée que les chiens de race mixte sains.
Seuils cytologiques et recherche
Chez les chats, une étude sur plaque de contact dans l’aisselle démontre que les chats de gouttière ne possèdent pas beaucoup de Malassezia. Les Cornish Rex ne présentent pas de Malassezia. Les Devon Rex séborrhéiques avec dépôt noirâtre montrent une croissance sur la plaque de contact. Les Devon Rex sains constituent un groupe intermédiaire entre ces extrêmes.
Statut immunitaire et hypersensibilité
Le statut immunitaire de l’hôte joue un rôle crucial dans l’interprétation des comptages. Certains animaux présentent une hypersensibilité immédiate détectable par test IgE, par sérologie ou tests intradermiques. D’autres montrent une hypersensibilité retardée lors du test intradermique. Chez les Basset Hounds, l’hypersensibilité de contact corrèle bien avec la maladie ou son absence. Les Basset Hounds sains ne montrent pas d’hypersensibilité de contact, contrairement aux malades qui la développent, si l’effort de réaliser des patch-tests sur les chiens est consenti, procédure non adaptée à la routine clinique quotidienne. Comme pour d’autres allergènes, le test IgE constitue précisément cela : un test IgE. Si un test intradermique est effectué, ce n’est pas un test de maladie mais un test de sensibilité immunologique. Un Basset Hound sain présentant une hypersensibilité immédiate spectaculaire et dramatique à Malassezia lors du test intradermique illustre cette dissociation entre sensibilité et maladie clinique.
Histopathologie
L’histopathologie peut être effectuée pour documenter les lésions de dermatite à Malassezia. Ce n’est sans doute pas la meilleure méthode pour chercher quelque chose résidant dans le stratum corneum en raison de la perturbation substantielle qui se produit dans les coupes normales fixées au formol et incluses en paraffine selon les protocoles histologiques standard. Sur une diapositive comparative, le stratum corneum normal montre l’orthokératose commune en panier tressé que les pathologistes observeraient en routine. En revanche, dans une coupe de cryostat – techniquement difficile à réaliser, couper de la peau dans un cryostat représentant un défi technique – l’observation révèle à quel point la bonne barrière, le stratum corneum intact, est densément tassée avec un grand empilement de squames constituant une barrière compacte. C’est un artefact de traitement, ce n’est absolument pas comme ça dans la vie réelle in vivo. Dans une micrographie électronique à balayage, le grand empilement de squames formant la barrière habituelle est visible. Le sceau lipidique manque, enlevé et éliminé par le traitement de préparation de l’échantillon, mais le grand empilement de squames persiste.
Artefacts et observations histologiques
Lorsqu’une biopsie d’un chien est examinée et montre tout ce stratum corneum absent ou tout ce matériau lâche et désorganisé, il s’agit d’un artefact histologique et non d’une représentation fidèle de la structure in vivo. Certaines caractéristiques importantes peuvent néanmoins être observées, incluant une hyperplasie épidermique irrégulière de l’épiderme interfolliculaire s’étendant dans l’infundibulum folliculaire. Une kératose est certainement présente. Un certain degré d’œdème et un infiltrat dermique superficiel périvasculaire ou interstitiel caractérisent les lésions. En raison de la perturbation substantielle du stratum corneum de surface lors du traitement histologique, un bon endroit pour rechercher la Malassezia réside dans les ostia ou infundibula folliculaires, structures moins perturbées que le stratum corneum superficiel. Dans un spécimen coloré à l’hématoxyline-éosine (H&E) standard, si cette zone est examinée à plus fort grossissement, les levures deviennent visibles. Bien que ces organismes puissent être visualisés avec la coloration H&E standard, ils peuvent être éclaircis et rendus plus évidents avec une coloration PAS (acide périodique de Schiff) et encore mieux mis en évidence avec une coloration à l’argent si nécessaire pour confirmation.
Caractéristiques histopathologiques clés
Les caractéristiques histopathologiques décrites par divers auteurs et documentées sont assez concises. Kératose, soit orthokératosique soit parakératosique, hyperplasie épidermique., spongiose. Exocytose lymphocytaire ou neutrophile et un infiltrat dermique lymphocytaire ou mixte. L’histopathologie chez les chats demeure moins bien définie et documentée. L’hyperkératose et l’hyperplasie constituent des caractéristiques importantes, mais les caractéristiques de la maladie sous-jacente déclenchant la prolifération de Malassezia pourraient également être observées dans les spécimens histologiques.
Algorithme diagnostique
Approche pas-à-pas
L’approche d’un cas suspect de dermatite à Malassezia débute logiquement par une anamnèse détaillée et l’identification de signes cliniques compatibles avec cette affection. L’étape suivante consiste à démontrer si la levure est présente ou non. Cela se fera normalement par cytologie en pratique clinique quotidienne, bien qu’en environnement de recherche cela puisse être effectué par culture, culture quantitative permettant une évaluation précise des populations. Les comptages n’ont pas nécessairement besoin d’être élevés pour justifier un traitement. Si les levures sont détectées en nombre raisonnable, une thérapie d’essai doit être initiée et la réponse observée attentivement. En leur absence lors de l’échantillonnage initial, un nouvel échantillonnage de sites supplémentaires ou la considération d’une autre explication diagnostique s’impose.
Interprétation de la réponse thérapeutique
Si les levures disparaissent totalement et les signes cliniques se résolvent complètement, le diagnostic de dermatite à Malassezia est établi avec confiance et la recherche d’une cause sous-jacente devient prioritaire pour prévenir les récidives. Si les levures disparaissent totalement avec amélioration clinique partielle globale, le diagnostic de dermatite à Malassezia est confirmé et l’investigation puis le traitement de l’allergie résiduelle, du trouble de desquamation ou du problème de pli anatomique doivent être entrepris. Le Westie Highland White Terrier classique hors de contrôle avec les médicaments conventionnels illustre parfaitement cette situation : le traitement de Malassezia et des staphylocoques révèle une dermatite atopique sous-jacente qui devient alors contrôlable avec des thérapies appropriées pour la gestion allergique. Si les levures disparaissent sans aucun bénéfice clinique, leur présence était incidente et non causale. Une disparition partielle des levures avec amélioration clinique partielle suggère une dermatite à Malassezia, nécessitant révision de l’observance thérapeutique, extension et intensification du traitement pour obtenir une élimination complète des levures. L’absence totale d’amélioration clinique avec persistance des levures impose la vérification rigoureuse de l’observance du propriétaire, la révision et modification du traitement, et la considération sérieuse d’une résistance potentielle aux antifongiques, particulièrement dans le contexte contemporain d’émergence de souches résistantes.
Stratégies thérapeutiques
Traitement systémique chez le chien
Des études d’efficacité sont rapportées pour le kétoconazole, l’itraconazole et le fluconazole comme azolés, ainsi que la terbinafine comme allylamine. Certaines études associaient la céfalexine concomitante en raison de l’importance des staphylocoques dans certaines zones géographiques et régionales. Le choix final dépendra de la disponibilité locale, des règles de prescription locales et réglementations pharmaceutiques, des facteurs individuels du patient incluant comorbidités et contre-indications, et des coûts qui peuvent varier considérablement d’un pays à l’autre. L’itraconazole et le kétoconazole constituent des options valides à administrer à un chien atteint de dermatite à Malassezia. Le fluconazole possède ses adeptes et défenseurs. C’est le moins actif en laboratoire en termes de microgrammes par millilitre lors des tests de concentrations minimales inhibitrices (CMI). La terbinafine nécessite une évaluation plus approfondie. Les concentrations dans le stratum corneum aux doses actuellement utilisées pourraient ne pas être suffisamment élevées selon une étude pharmacocinétique publiée.
Traitement topique chez le chien
Les données d’efficacité pour les topiques concernent le shampooing miconazole-chlorhexidine, les shampooings à 3% de chlorhexidine, les conditionneurs au miconazole, et un produit à base d’huiles essentielles appelé MalAcetic. Deux études contrôlées randomisées en aveugle démontrent une bonne activité clinique du shampooing miconazole-chlorhexidine. Des essais cliniques sur le Malaseb (Miconazole-Chlorhexidine) menés en juillet 1994 montrèrent des résultats remarquables. Ces chiens sévèrement atteints de dermatite à Malassezia, initialement jugés nécessiter kétoconazole systémique et céfalexine antibactérienne selon l’évaluation clinique initiale, reçurent uniquement du shampooing Malaseb comme seul traitement à intervalles de trois jours pendant trois semaines.
L’élimination simultanée des staphylocoques et des Malassezia avec ce produit s’avère importante car certaines microscopies électroniques de certains échantillons de brossage par cupule révèlent les levures intégrées mais entourées de nombreux cocci bactériens, soulignant l’importance de cibler simultanément staphylocoques et Malassezia dans ces infections mixtes. Sur la base de l’examen méthodique des études publiées, le miconazole-chlorhexidine représente le traitement topique de premier choix en supposant que l’animal l’accepte et tolère les bains et que le propriétaire puisse l’appliquer correctement et régulièrement.
Traitement auriculaire chez le chien
Les otites externes à Malassezia pachydermatis chez le chien constituent une affection fréquente nécessitant un traitement topique antifongique adapté. Sur le marché, on trouve actuellement plusieurs spécialités vétérinaires reposant principalement sur deux familles d’antifongiques : les dérivés azolés et les allylamines. Parmi les approches thérapeutiques couramment utilisées, on retrouve des associations de miconazole avec gentamicine et acéponate d’hydrocortisone, indiquées dans le traitement des otites externes aiguës et récurrentes dues à des champignons sensibles aux azolés. D’autres formulations classiques combinent clotrimazole, gentamicine et bétaméthasone pour les otites d’origine bactérienne et fongique. Les associations de florfénicol et terbinafine ciblent spécifiquement les infections mixtes à Staphylococcus pseudintermedius et Malassezia pachydermatis. Ces formulations polyvalentes associent systématiquement antibiotique, antifongique et corticoïde, ce qui limite les possibilités de traitement spécifique.chvsm+3
Une innovation thérapeutique récente sur le marché français constitue le premier topique auriculaire longue action sans antibiotique spécifiquement développé pour les otites à Malassezia pachydermatis. Cette formulation originale associe 10 mg de terbinafine, une allylamine fongicide inhibant la synthèse de l’ergostérol membranaire, et 1 mg d’acétate de bétaméthasone pour son action anti-inflammatoire. Le format gel longue action permet une application unique facilitant l’observance thérapeutique. Les études de sensibilité menées entre 2021 et 2023 sur des isolats européens de Malassezia ont établi des CMI50 et CMI90 respectivement de 0,12 et 0,25 μg/ml pour la terbinafine. Cette spécialité s’inscrit dans une approche d’antibiothérapie raisonnée en proposant une alternative sans antibiotique systématique, particulièrement pertinente lors d’otites purement fongiques ne nécessitant pas de couverture antibactérienne.
Traitement chez le chat
Chez le chat, plusieurs études ouvertes non contrôlées utilisèrent l’itraconazole à des doses comprises entre 5 et 10 mg/kg une fois par jour, soit en continu quotidiennement, soit selon un protocole intermittent sept jours avec traitement, sept jours sans traitement, sept jours avec traitement, correspondant à la licence Itrafungol pour la dermatophytose au Royaume-Uni. Les données demeurent limitées pour les chats en général. L’azolé systémique de premier choix serait l’itraconazole selon le consensus clinique. Le kétoconazole n’est vraisemblablement administré à aucun chat en raison de préoccupations concernant la tolérance et la sécurité. La thérapie topique manque également de données scientifiques rigoureuses.
Prévention et gestion des rechutes
Immunothérapie spécifique
La découverte et la correction des maladies sous-jacentes constituent la pierre angulaire absolue de la prévention des rechutes. Une posologie pulsée, soit topique soit systémique, peut être envisagée lorsque tout le reste échoue, avec le souci constant de la résistance aux antifongiques. Les preuves pour l’immunothérapie spécifique aux allergènes pour Malassezia manquent, bien que de nombreux praticiens l’utilisent couramment. Lors d’une discussion antérieure, il fut établi que beaucoup de participants incluent Malassezia dans leurs panels de tests intradermiques et l’incorporent dans leurs formulations d’immunothérapie lors de réactivité positive. En l’absence de preuves convaincantes et rigoureuses, l’inclusion de Malassezia dans l’immunothérapie spécifique aux allergènes repose davantage sur un consensus d’experts que sur des données probantes robustes.
Stratégies de maintenance
L’approche rationnelle pour un animal hypersensible à Malassezia consiste à minimiser le défi antigénique en maintenant les populations de levures basses, aussi basses que possible. Cela pourrait signifier une thérapie topique très régulière et assidue si les animaux peuvent être baignés et que les propriétaires peuvent accomplir cette tâche répétitivement. Cela pourrait signifier des azolés pulsés administrés de manière intermittente, mais bien sûr, la préoccupation légitime existe concernant la promotion de la résistance aux antifongiques.
Résistance aux antifongiques : mécanismes et enjeux
Il existe des rapports croissants et préoccupants du développement de résistance aux médicaments antifongiques mais à distribution hétérogène, principalement décrits avec la classe des azolés, qui sont utilisés routinièrement et globalement dans le traitement des infections canines à Malassezia. Elle est endémique et fréquente dans certaines régions d’Asie de l’Est, mais reste sporadique en Europe et en Amérique du Nord. Malheureusement, la surveillance de la résistance aux antifongiques accuse un retard substantiel par rapport à celle effectuée pour les pathogènes bactériens. Cette situation découle en partie d’un manque de méthodes de laboratoire standardisées et de soumissions peu fréquentes d’échantillons pour culture et tests de sensibilité. La résistance chez Malassezia et autres champignons, ainsi que chez les pathogènes humains, constitue une préoccupation majeure absolue. Les méthodes standard pour tests de sensibilité des levures sont optimisées par des organisations comme le CLSI (Clinical and Laboratory Standards Institute) aux États-Unis et l’EUCAST (European Committee on Antimicrobial Susceptibility Testing) en Europe, optimisées spécifiquement pour Candida et Cryptococcus. Cette focalisation, compte tenu de l’importance considérable de ces pathogènes en médecine humaine, est tout à fait justifiée et compréhensible. Toutefois, le milieu de culture tissulaire RPMI 1640 qu’ils recommandent pour ce processus de test ne supporte pas la croissance de Malassezia. À partir de ce point fondamental, tout devient improvisé et non standardisé. Il n’existe pas de protocole approprié validé pour Malassezia.
Alternatives thérapeutiques et recherches en cours
Produits innovants et naturels
Les préoccupations légitimes concernant la résistance médicamenteuse stimulent les efforts pour identifier des traitements efficaces au-delà des antifongiques conventionnels azolés et allylamines. De nos jours, au cours des sept à huit dernières années, beaucoup d’études ont été réalisées en utilisant toutes sortes de choses différentes non-azolées, non-terbinafine pour essayer de tuer Malassezia in vitro. La plupart de ces approches ont été faites in vitro et n’ont pas été étendues à un essai clinique contrôlé randomisé rigoureux sur des patients réels. Des études récentes sur l’otite examinent différents produits innovants : un nettoyant auriculaire contenant de la grenade comme principe actif, un produit à base de plantes pour traiter l’otite, un rinçage auriculaire à base de résine d’épicéa de Norvège, puis un produit plus conventionnel contenant du posaconazole, qui est bien sûr un antifongique azolé de gros calibre et très puissant. Quelques études sur la dermatite examinent des shampooings contenant de l’argent colloïdal et des sprays contenant du peroxyde de benzoyle et de l’alcool et des huiles botaniques diverses. Un shampooing aux nanoparticules d’argent montra des résultats prometteurs dans une étude ouverte non randomisée méthodologiquement limitée. Des rapports in vitro décrivent l’efficacité contre M. pachydermatis d’un gel à base de miel, de la monensine et, dans une moindre mesure, de la narasine. Ces ionophores polyéthers furent originellement commercialisés comme anticoccidiens pour la volaille et comme modificateurs promoteurs de croissance de la flore ruminale bovine, et présentent apparemment une activité antifongique in vitro.
Huiles essentielles et limites
De multiples publications récentes explorent l’utilité antifongique potentielle des huiles essentielles, mélanges complexes d’huiles aromatiques hautement concentrées (principalement terpènes et/ou phénylpropanoïdes) extraites de plantes par distillation à la vapeur, hydrodiffusion ou pression mécanique. La plupart des investigations ont été conduites in vitro et leur utilité réelle en pratique clinique reste largement non testée cliniquement. Les comparaisons entre études sont entravées et rendues difficiles par l’absence de méthodes de test standard optimisées et validées, l’attribution arbitraire de critères interprétatifs sans validation rigoureuse, et la variation probable entre lots différents d’activités des huiles essentielles préparées par différentes méthodes d’extraction et provenant de sources végétales variables. La majorité écrasante de ces approches alternatives ont été réalisées in vitro dans des tubes à essai sans extension à des essais cliniques contrôlés randomisés sur des patients réels avec évaluation rigoureuse de l’efficacité clinique.
Recommandations pratiques et perspectives
La cytologie devrait être effectuée systématiquement en pratique canine courante pour rechercher ces levures opportunistes et établir ou infirmer leur implication dans le tableau clinique.
Si la levure est traitée, le comptage précis n’est probablement pas nécessaire. Trouvez-la simplement en nombre raisonnable avec des signes cliniques compatibles, traitez-la et observez la réponse clinique. Suivez les patients avec réévaluations régulières et refaites la cytologie et voyez si la levure a disparu et évaluez cela par rapport à la réponse clinique observée. Le traitement doit être individualisé en fonction des différentes circonstances du patient incluant comorbidités et contre-indications, et des circonstances du propriétaire incluant capacité financière et compliance probable. Certainement un azolé systémique constitue une option valide pour les cas qui ne peuvent être shampooinés et autres situations où les topiques sont impraticables. Tout au long du processus thérapeutique, il faut constamment essayer de trouver et de corriger le facteur déclenchant sous-jacent car si cela peut être accompli, les infections récidivantes peuvent être réduites, le besoin de médicaments antifongiques peut être réduit, et donc la pression de sélection qui pourrait conduire vers l’émergence et la propagation de résistance peut être minimisée.
Conclusion
Au cours des 35 dernières années, une expansion remarquable des connaissances concernant les affections cutanées liées à Malassezia chez les chiens et chats a été réalisée. La plupart des praticiens vétérinaires sont désormais à l’aise pour reconnaître les présentations cliniques variées de la dermatite et de l’otite à Malassezia et pour observer les levures caractéristiques en cytologie de routine. La nécessité d’évaluer et de corriger, dans la mesure du possible, les facteurs prédisposants et affections sous-jacentes est bien comprise par la communauté vétérinaire contemporaine.
L’émergence préoccupante de la résistance aux azolés parmi les espèces de Malassezia nécessite une surveillance attentive et continue ainsi qu’une gestion rigoureuse de ces produits pharmaceutiques pour garantir l’utilité continue de cette classe médicamenteuse importante pour les décennies à venir. Le développement de tests de sensibilité antifongique standardisés appropriés et validés pour utilisation par les laboratoires commerciaux et cliniques de microbiologie est absolument critique et urgent. Des données supplémentaires sont urgemment nécessaires pour établir définitivement si les thérapies topiques sont préférables aux traitements systémiques dans le contexte de la prévention de la résistance, et pour guider les politiques de gestion antimicrobienne (antimicrobial stewardship policies) concernant la thérapie antifongique en pratique vétérinaire des petits animaux.
Bond R. Malassezia review Parts i and ii: Clinical signs, Diagnosis, therapy and resistance. NAVDF 2025 Meeting