La tumeur mammaire chez la chienne constitue la néoplasie la plus fréquemment diagnostiquée chez les femelles non stérilisées, représentant un défi clinique majeur en oncologie vétérinaire. Les données épidémiologiques confirment cette prépondérance : les tumeurs mammaires représentent 50 à 70 % de l’ensemble des néoplasmes chez la chienne intacte, avec une incidence rapportée jusqu’à trois fois supérieure à celle observée chez la femme.
Qu’est-ce qu’une tumeur mammaire ?
La tumeur mammaire chez la chienne constitue la néoplasie la plus fréquemment diagnostiquée chez les femelles non stérilisées, représentant un défi clinique majeur en oncologie vétérinaire. Les données épidémiologiques confirment cette prépondérance : les tumeurs mammaires représentent 42 à 70 % de l’ensemble des néoplasmes chez la chienne intacte. Historiquement, l’incidence des tumeurs mammaires chez la chienne était estimée jusqu’à trois fois supérieure à celle du cancer du sein chez la femme. Cependant, des études épidémiologiques comparatives plus récentes suggèrent un ratio plus modéré, de l’ordre de 1,4, bien que cela puisse varier selon les régions. Cette incidence élevée confirme néanmoins le statut du chien comme un modèle spontané pertinent pour la recherche en oncologie comparée, notamment pour l’étude des facteurs de risque environnementaux partagés. Cette pathologie se définit comme une prolifération anormale et non contrôlée de cellules issues du tissu des glandes mammaires. Une distinction fondamentale doit être établie entre les tumeurs bénignes et les tumeurs malignes. Les études convergent pour indiquer qu’environ 50 % des tumeurs mammaires chez la chienne sont de nature maligne, ce qui souligne la gravité potentielle de toute grosseur détectée.
La classification histopathologique des tumeurs mammaires chez le chien est complexe, reflétant la diversité des origines cellulaires au sein de la glande mammaire. Les néoplasmes peuvent provenir des cellules épithéliales (donnant des carcinomes simples ou des adénomes simples), des cellules myoépithéliales, du tissu conjonctif mésenchymateux (sarcomes), ou d’une combinaison de ces lignées (carcinomes complexes, tumeurs mixtes). Parmi les formes malignes les plus courantes, on retrouve l’adénocarcinome, le carcinome solide et le carcinosarcome. Les formes bénignes fréquentes incluent l’adénome simple, le fibroadénome et la tumeur mixte bénigne. Cette classification, initialement établie par l’Organisation Mondiale de la Santé (OMS), a fait l’objet de mises à jour successives pour affiner la précision du diagnostic d’une tumeur et du pronostic d’une tumeur mammaire.
Une observation clinique et histologique fondamentale est l’existence d’un continuum évolutif entre les lésions bénignes et malignes. Cette progression est souvent corrélée à l’augmentation du volume de la tumeur. Des études ont démontré que si la quasi-totalité (98 %) des grosseurs de moins de 1 cm sont bénignes, la probabilité de malignité augmente de façon spectaculaire avec la taille, atteignant 50 % pour les tumeurs de plus de 3 cm. Les tailles des tumeurs mammaires peuvent donc varier considérablement, ce qui constitue un critère important lors de l’examen clinique. Cette corrélation suggère un processus biologique dynamique où certaines lésions bénignes pourraient héberger des cellules prémalignes. Sous l’influence de stimuli prolifératifs continus, notamment hormonaux, ces cellules peuvent subir une transformation maligne au fil du temps. Il en découle une implication clinique majeure : une approche attentiste (“surveiller et attendre”) face à une boule mammaire, même de petite taille et d’apparence bénigne, est une stratégie à haut risque. Chaque nodule doit être considéré comme potentiellement pré-malin, justifiant une intervention précoce pour optimiser la chance de guérison. La conséquence de la progression d’une tumeur mammaire bénigne vers une forme maligne peut être une aggravation du pronostic et une diminution des chances de traitement efficace.
Symptômes et diagnostic
Le principal signe clinique d’une tumeur mammaire est la découverte, souvent fortuite par le propriétaire ou lors d’un examen de routine, d’une masse, de nodules ou de grosseurs palpables au niveau d’une ou plusieurs mamelles. La présentation clinique est variable : la taille peut aller d’un grain de riz à une masse de plusieurs centimètres, la consistance peut être ferme ou molle, et la boule peut être mobile ou adhérente aux plans profonds. Une localisation préférentielle au niveau des deux paires de mamelles les plus caudales (inguinales et abdominales caudales) est fréquemment rapportée. Des signes locaux plus avancés, tels que l’ulcération de la peau, un érythème, un œdème local ou un écoulement au niveau du mamelon, suggèrent souvent une nature plus agressive de la tumeur.
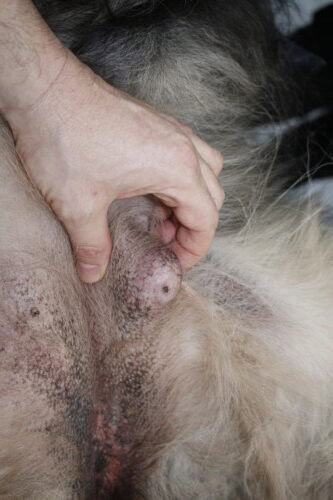
Photos Dr Laurent Findji
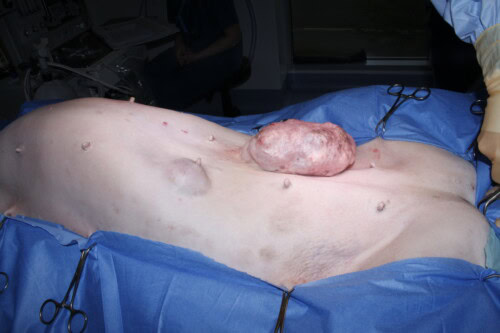
Photos Dr Laurent Findji
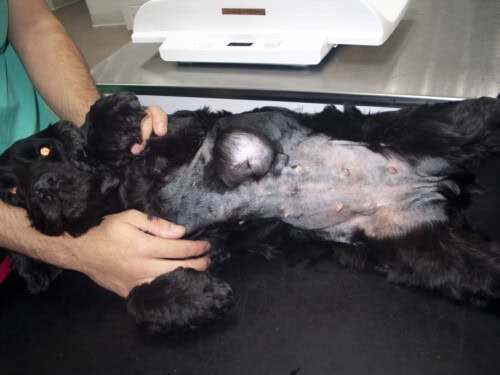
Photos Dr Laurent Findji
Lorsque la maladie progresse et que des métastases se développent, des symptômes généraux ou des troubles systémiques peuvent apparaître. Ceux-ci incluent une perte de poids, une léthargie, une diminution de l’appétit et une altération de l’état général. Des signes plus spécifiques peuvent orienter vers la localisation des métastases : des difficultés respiratoires ou une toux en cas d’atteinte pulmonaire, une boiterie en cas de métastase osseuse, ou une polyuro-polydipsie (augmentation de la prise de boisson et de la miction) liée à une hypercalcémie paranéoplasique. Une forme clinique particulière et redoutable est le carcinome mammaire inflammatoire. Il se caractérise par une augmentation rapide et diffuse du volume d’une ou plusieurs mamelles, qui deviennent chaudes, rouges, douloureuses et œdématiées, mimant une mammite. Son potentiel métastatique est extrêmement élevé et son pronostic est sombre.
La démarche diagnostique doit être rigoureuse et systématique, aboutissant à un bilan d’extension complet qui déterminera la stratégie de prise en charge.
-
Examen clinique : L’étape initiale est une palpation méticuleuse des deux chaînes mammaires pour identifier toutes les lésions, ainsi que des nœuds lymphatiques régionaux de drainage (axillaires pour les mamelles 1, 2 et 3 ; inguinaux pour les mamelles 3, 4 et 5).
-
Cytoponction à l’aiguille fine : Cet examen est utile pour écarter d’autres types de masses cutanées (lipome, mastocytome) mais présente des limites importantes pour le diagnostic des tumeurs mammaires. En raison de l’hétérogénéité fréquente du tissu tumoral, un prélèvement cytologique ne permet pas de conclure avec certitude sur la nature bénigne ou maligne, ni d’établir un grade histologique.
-
Analyse histopathologique : Elle représente l’examen de référence (“gold standard”). La biopsie excisionnelle, consistant en l’ablation complète de la tumeur, est la méthode de choix car elle est à la fois diagnostique et thérapeutique. Il est impératif de soumettre chaque nodule retiré à l’analyse, car il est fréquent d’observer des types histologiques différents chez le même animal. Grâce à l’analyse histopathologique, il est possible d’obtenir un diagnostic précis, d’évaluer le grade de malignité et d’orienter le pronostic ainsi que la prise en charge thérapeutique.
-
Bilan d’extension : Avant toute chirurgie, il est fondamental d’évaluer la présence éventuelle de métastases. Le protocole minimal inclut des radiographies thoraciques sous trois incidences (profils droit et gauche, et ventro-dorsale) pour rechercher des métastases pulmonaires. La sensibilité de cet examen est cependant limitée à la détection de nodules de plus de 8 mm. Le scanner (tomodensitométrie) thoraco-abdominal est l’examen de choix, offrant une sensibilité bien supérieure (détection de nodules de moins de 2 mm) et permettant une évaluation précise des nœuds lymphatiques et des organes abdominaux. Une échographie abdominale peut compléter le bilan, notamment dans le cadre du diagnostic d’une tumeur mammaire.
Ce bilan permet de stadifier la tumeur selon le système TNM, un outil pronostique universel.
Table 1 : Système de stadification clinique TNM pour les tumeurs mammaires canines (OMS modifiée)
|
Stade Clinique |
T (Taille de la tumeur) |
N (Nœuds lymphatiques) |
M (Métastases à distance) |
|---|---|---|---|
|
I |
T1 (< 3 cm) |
N0 (non atteints) |
M0 (absentes) |
|
II |
T2 (3 à 5 cm) |
N0 (non atteints) |
M0 (absentes) |
|
III |
T3 (>5 cm) |
N0 (non atteints) |
M0 (absentes) |
|
IV |
Tout T |
N1 (atteints) |
M0 (absentes) |
|
V |
Tout T |
Tout N |
M1 (présentes) |
Causes et facteurs de risque
L’étiologie de la tumeur mammaire chez le chien est multifactorielle, mais l’influence hormonale constitue la cause principale et la mieux documentée. Les hormones sexuelles ovariennes, en particulier les œstrogènes et la progestérone, jouent un rôle prépondérant dans la prolifération du tissu mammaire et la tumorigenèse. Leur action est médiée par des récepteurs spécifiques présents sur les cellules mammaires et peut être amplifiée par des facteurs de croissance comme le GH (Growth Hormone) et l’IGF-1 (Insulin-like Growth Factor I).
La mesure préventive la plus efficace est directement liée à ce facteur hormonal : la stérilisation. Elle est reconnue comme la mesure préventive la plus efficace. Des données historiques fondatrices suggèrent une réduction drastique du risque, avec une incidence rapportée de 0,5 % pour une stérilisation avant les premières chaleurs, 8 % après les premières, et 26 % après les deuxièmes. Bien que ce bénéfice protecteur soit un consensus, des revues systématiques récentes ont souligné les limites méthodologiques des études originales. La décision du moment de la stérilisation doit donc être discutée avec un vétérinaire, en considérant une évaluation globale des risques et bénéfices pour la santé de l’animal..
Des facteurs génétiques et une prédisposition raciale sont également bien établis. Les chiens de race pure sont plus fréquemment atteints que les chiens croisés. Certaines races sont systématiquement surreprésentées dans les études, incluant notamment le Caniche, le Cocker Spaniel, l’English Springer Spaniel, le Teckel, le Berger Allemand et le Yorkshire Terrier. Cette prédisposition suggère une composante héréditaire. L’implication des gènes suppresseurs de tumeur BRCA1 et BRCA2, dont les mutations sont un facteur de risque majeur de cancer du sein héréditaire chez la femme, a été étudiée chez la chienne. Bien que des altérations de ces gènes aient été identifiées dans des tumeurs mammaires canines, leur rôle exact en tant que facteur de prédisposition majeur n’est pas aussi clairement établi que chez l’humain et fait l’objet de recherches intenses, notamment par des approches génomiques à grande échelle.
L’âge est un autre facteur de risque critique. L’apparition de la maladie est rare chez les chiennes de moins de 5 ans. L’incidence augmente progressivement avec l’âge, avec un pic de fréquence observé entre 7 et 13 ans. Il est à noter que l’âge moyen au moment du diagnostic tend à être légèrement plus élevé pour les tumeurs malignes que pour les tumeurs bénignes.
Enfin, l’alimentation et le statut pondéral ont un impact non négligeable. L’obésité, surtout lorsqu’elle survient à un jeune âge (autour d’un an), est reconnue comme un facteur favorisant. Le mécanisme sous-jacent est double : le tissu adipeux est une source de production d’œstrogènes via une enzyme appelée aromatase, et il libère également des adipokines comme la leptine, qui peuvent stimuler la prolifération cellulaire. Une alimentation riche en viandes rouges a également été associée à une augmentation du risque.
L’étude des causes des tumeurs mammaires canines s’inscrit dans une perspective plus large, celle du concept “One Health” (“Une seule santé”). Les nombreuses similitudes entre la tumeur mammaire canine et le cancer du sein humain – qu’il s’agisse des facteurs de risque hormonaux, génétiques et nutritionnels, des voies moléculaires ou même de la distribution géographique – sont frappantes. Le chien, partageant notre environnement et notre mode de vie, agit comme une sentinelle. Son espérance de vie plus courte accélère la manifestation de maladies liées à des facteurs environnementaux. La corrélation entre de fortes incidences dans les deux espèces au sein des mêmes zones urbanisées suggère que des expositions communes (polluants, facteurs de style de vie) pourraient jouer un rôle. Ainsi, la recherche sur les facteurs de risque chez le compagnon canin dépasse le simple cadre vétérinaire et pourrait offrir des pistes précieuses pour la prévention du cancer du sein chez la femme, illustrant l’interconnexion profonde entre la santé animale et humaine, et soulignant l’importance d’étudier ces maladies chez les animaux pour mieux comprendre les enjeux de santé publique globale.
Prise en charge et traitement des tumeurs des glandes mammaires
La prise en charge de la tumeur mammaire chez la chienne est multimodale et doit être adaptée à chaque cas en fonction du stade clinique et du type histologique. Le traitement chirurgical constitue la pierre angulaire de la thérapie.
L’exérèse chirurgicale est le traitement de choix pour le contrôle locorégional de la maladie. Le cours de l’intervention chirurgicale comprend la planification préopératoire, l’ablation complète de tout le tissu tumoral, et la gestion post-opératoire. Plusieurs options chirurgicales existent, et le choix dépend de la taille, du nombre et de la localisation des tumeurs.
-
Nodulectomie (ou lumpectomie) : Retrait de la seule masse. Cette approche conservatrice est réservée aux nodules uniques, de très petite taille (< 0,5−1 cm), mobiles et d’apparence bénigne.
-
Mastectomie simple : Retrait de la totalité de la mamelle concernée. Elle est indiquée pour les tumeurs plus volumineuses ou centrales.
-
Mastectomie régionale : Retrait en bloc de la tumeur, des mamelles adjacentes et du nœud lymphatique de drainage. La décision se base sur le drainage lymphatique connu (par exemple, retrait des mamelles 1, 2, 3 et du nœud axillaire pour une tumeur sur M1 ou M2).
-
Mastectomie radicale (ou unilatérale) : Retrait de l’ensemble de la chaîne mammaire et des nœuds lymphatiques associés (axillaire et inguinal). C’est l’intervention de choix en cas de tumeurs multiples sur une même chaîne.
Pour les tumeurs malignes, l’obtention de marges chirurgicales saines (sans cellules cancéreuses) est un objectif primordial, dont la confirmation ne peut être apportée que par l’analyse histopathologique. La réalisation d’une ovariohystérectomie en même temps que la chirurgie mammaire est fortement recommandée. Des études ont montré que cette intervention réduit le risque de formation de nouvelles tumeurs et peut augmenter l’espérance de vie des patientes porteuses de tumeurs exprimant des récepteurs hormonaux.
La chimiothérapie adjuvante n’est pas systématique mais il est parfois nécessaire de faire appel à ce traitement pour les cas à haut risque de métastases. Les indications incluent les tumeurs de grande taille (>3 cm), de grade histologique élevé (Grade III), la présence d’emboles vasculaires ou lymphatiques à l’histologie, ou une atteinte ganglionnaire (Stade IV) ou des métastases à distance (Stade V) avérées.
La place de la chimiothérapie adjuvante reste néanmoins l’un des domaines les plus débattus. Contrairement à l’oncologie humaine, il n’existe actuellement aucun protocole standardisé dont l’efficacité sur l’augmentation de la survie a été démontrée par de larges essais cliniques randomisés. Des agents comme la doxorubicine ou le carboplatine sont utilisés, mais leur bénéfice reste incertain et la décision est prise au cas par cas, en discutant des faibles preuves existantes avec le propriétaire.
.
Table 2 : Exemples de protocoles de chimiothérapie adjuvante pour les carcinomes mammaires canins
|
Protocole |
Molécule(s) |
Posologie |
Voie & Fréquence |
Indications principales |
|---|---|---|---|---|
|
Doxorubicine (agent seul) |
Doxorubicine |
30 mg/m2 |
IV, toutes les 3 semaines (4-6 cycles) |
Carcinomes de haut grade, maladie métastatique. Surveillance cardiaque requise. |
|
Carboplatine (agent seul) |
Carboplatine |
300 mg/m2 |
IV, toutes les 3 semaines (4-6 cycles) |
Alternative à la doxorubicine, notamment en cas de risque cardiaque. |
|
Protocole AC |
Doxorubicine + Cyclophosphamide |
Doxo : 25-30 mg/m2 ; Cyclo : 100 mg/m2 |
IV, toutes les 3 semaines (4 cycles) |
Combinaison classique pour les carcinomes de haut grade. |
|
Protocole métronomique |
Cyclophosphamide |
12.5 mg/m2 |
PO, quotidiennement |
Thérapie anti-angiogénique, souvent en association ou en relais de la chimiothérapie conventionnelle. |
La radiothérapie a des indications plus ciblées. Elle peut être utilisée en post-opératoire sur le site chirurgical en cas d’exérèse incomplète (marges “sales”) pour limiter le risque de récidive locale. Elle a également un rôle palliatif important pour les tumeurs inopérables, afin de réduire la douleur. Son indication la plus spécifique est le traitement du carcinome mammaire inflammatoire, pour lequel la chirurgie est contre-indiquée.
Enfin, des thérapies plus récentes émergent. L’hormonothérapie avec l’aglepristone, un antagoniste des récepteurs à la progestérone, a montré une certaine efficacité en traitement néoadjuvant (avant la chirurgie) pour réduire la taille des tumeurs exprimant ces récepteurs, facilitant ainsi l’intervention. Les thérapies ciblées, comme les inhibiteurs de la cyclooxygénase-2 (COX-2) (par exemple, firocoxib) ou les inhibiteurs de tyrosine kinases (par exemple, toceranib), représentent une voie d’avenir prometteuse vers une médecine plus personnalisée, en ciblant des mécanismes spécifiques de la croissance tumorale. La cyclo oxygénase joue un rôle clé dans la croissance tumorale et son inhibition peut améliorer le pronostic et la survie des animaux atteints de tumeurs mammaires.
Prévention et mesures de précaution
La prévention de l’apparition d’une tumeur mammaire repose sur des mesures simples mais d’une efficacité remarquable. La pierre angulaire de cette stratégie est sans conteste la stérilisation précoce, particulièrement recommandée chez la femelle, population la plus concernée par ce type de tumeur. L’ovariohystérectomie réalisée avant les premières chaleurs est la méthode la plus efficace connue à ce jour pour limiter le risque de formation de cette pathologie, le réduisant à près de zéro (0,5 %). Cette protection diminue significativement avec chaque cycle œstral vécu par la chienne, soulignant l’importance d’une décision précoce pour la santé à long terme de l’animal.
Une autre mesure de précaution essentielle est d’éviter l’utilisation de contraceptifs hormonaux, qu’ils soient oraux ou injectables. Ces produits, généralement à base de progestatifs, augmentent de manière significative le risque de développer non seulement des tumeurs mammaires mais aussi d’autres affections comme le pyomètre (infection de l’utérus).
La gestion du poids et une alimentation saine constituent le troisième pilier de la prévention. Le maintien d’un poids de forme, en évitant l’obésité surtout durant la première année de vie, est crucial. Une alimentation équilibrée et adaptée aux besoins spécifiques du compagnon canin, sans excès, contribue à un environnement métabolique moins propice au développement tumoral.
Pour les chiennes qui n’ont pas pu bénéficier d’une stérilisation précoce et qui sont donc considérées à risque, une surveillance active est recommandée. Cela inclut une palpation régulière des mamelles par les propriétaires, au moins une fois par mois, afin de détecter toute modification ou l’apparition de la moindre boule le plus tôt possible. Cette vigilance doit être complétée par un examen clinique annuel approfondi réalisé par un vétérinaire. La détection précoce est un facteur pronostique majeur qui augmente considérablement les chances de succès du traitement et de guérison.
Pronostic et espérance de vie
Le pronostic et l’espérance de vie d’une chienne atteinte d’une tumeur mammaire maligne sont variables et dépendent d’une combinaison de plusieurs facteurs pronostiques cliniques et pathologiques. Il n’existe pas de réponse unique, mais une évaluation rigoureuse de ces critères permet d’établir une estimation la plus précise possible. La tumeur mammaire est une affection très fréquente, représentant environ 50% des cas de cancer chez la chienne non stérilisée, mais l’issue n’est pas une fatalité si la maladie est traité à un stade précoce.
Les facteurs pronostiques les plus déterminants sont les suivants :
-
La taille de la tumeur (T) : C’est l’un des indicateurs les plus puissants. Les tumeurs de petite taille au moment du diagnostic sont associées à un bien meilleur pronostic. Un seuil critique est souvent fixé à 3 cm. Les chiens avec des tumeurs de moins de 3 cm de diamètre ont une espérance de vie significativement plus longue que ceux dont les tumeurs dépassent 5 cm.
-
Le statut des nœuds lymphatiques (N) : L’envahissement des nœuds lymphatiques régionaux par les cellules cancéreuses est un signe de dissémination de la maladie et assombrit considérablement le pronostic. Une atteinte ganglionnaire classe la tumeur au minimum au stade IV, indiquant que le cancer n’est plus seulement local.
-
La présence de métastases à distance (M) : La détection de métastases dans des organes éloignés, comme les poumons ou le foie (stade V), est le facteur pronostique le plus péjoratif. Dans ce cas, la survie se compte généralement en mois.
-
Le grade histologique : Déterminé après l’analyse du tissu tumoral, le grade évalue l’agressivité des cellules. Un grade I (bien différencié) est de bon pronostic, tandis qu’un grade III (peu différencié, anaplasique) est associé à un risque élevé de récidive et de métastases, et donc à une survie plus courte.
-
Le type histologique : Certains types de tumeurs malignes, comme les sarcomes ou le carcinome inflammatoire, ont un pronostic intrinsèquement plus défavorable, indépendamment des autres facteurs.
-
L’invasion vasculaire ou lymphatique : La mise en évidence d’emboles tumoraux (amas de cellules cancéreuses) dans les vaisseaux sanguins ou lymphatiques au sein ou autour de la tumeur est un indicateur fort de sa capacité à métastaser.
En synthèse, le meilleur scénario est celui d’une petite tumeur (< 3 cm), de bas grade, sans atteinte ganglionnaire ni métastases à distance, retirée chirurgicalement avec des marges saines. À l’inverse, une tumeur volumineuse, de haut grade, avec envahissement ganglionnaire, a un pronostic réservé à sombre. Des études montrent que 50 à 75 % des chiennes atteintes de tumeurs malignes non traitées ou traitées tardivement décèdent dans un délai de 1 à 2 ans suite à la progression métastatique.
Table 3 : Facteurs pronostiques majeurs pour les tumeurs mammaires malignes chez la chienne
|
Facteur Pronostique |
Pronostic Favorable |
Pronostic Défavorable |
|
Taille de la tumeur |
<3 cm de diamètre |
>5 cm de diamètre |
|
Statut ganglionnaire |
Nœuds lymphatiques non atteints (N0) |
Nœuds lymphatiques atteints (N1) |
|
Métastases à distance |
Absentes (M0) |
Présentes (M1) |
|
Grade histologique |
Grade I (bien différencié) |
Grade III (peu différencié/anaplasique) |
|
Invasion vasculaire |
Absente |
Présente |
|
Ulcération de la tumeur |
Non ulcérée |
Ulcérée |
Autres questions fréquentes
Comment savoir si mon chien souffre d’un cancer ?
La reconnaissance de la douleur chez un animal atteint de cancer est fondamentale pour maintenir sa qualité de vie. Les chiens sont souvent stoïques et ne manifestent pas leur douleur de manière évidente, comme par des gémissements. Il faut être attentif à des signes plus subtils : une modification du comportement (isolement, irritabilité, agressivité), une réticence à bouger, à sauter ou à monter les escaliers, une boiterie, un halètement excessif même au repos, des tremblements, ou un léchage compulsif d’une zone particulière. Une perte d’appétit ou des troubles du sommeil sont également des indicateurs. Si un de ces signes est observé, une consultation est nécessaire pour mettre en place une gestion de la douleur adaptée, qui peut inclure des anti-inflammatoires, des opioïdes ou d’autres analgésiques.
Quelle espérance de vie chez le chien qui a un cancer ?
L’espérance de vie d’un chien atteint d’une tumeur mammaire n’est pas une donnée fixe. Elle dépend entièrement des facteurs pronostiques établis lors du bilan d’extension et de l’analyse histopathologique. Comme détaillé précédemment, la taille de la tumeur, son grade, l’atteinte des nœuds lymphatiques et la présence de métastases sont les critères déterminants. Un chien avec une petite tumeur maligne de bas grade retirée complètement peut vivre de nombreuses années, parfois sans jamais voir de récidive. À l’inverse, un chien diagnostiqué à un stade avancé avec des métastases a une espérance de vie malheureusement très limitée, souvent de quelques mois. La clé réside dans un diagnostic et un traitement les plus précoces possibles.
Comment nettoyer une tumeur cutanée des glandes mammaires ?
Le nettoyage d’une tumeur cutanée, en particulier si elle est ulcérée, vise à prévenir les surinfections bactériennes et à améliorer le confort de l’animal. Il ne s’agit en aucun cas d’un traitement curatif. Cette procédure doit être réalisée avec douceur. Il est recommandé d’utiliser une solution saline stérile ou une solution antiseptique diluée (comme la chlorhexidine), appliquée sur des compresses stériles. Il faut éviter de frotter la lésion. Après nettoyage, la zone doit être séchée délicatement par tamponnement. L’application de pommades ou de crèmes ne doit se faire que sur prescription vétérinaire. Il est crucial de ne pas manipuler excessivement la masse, car cela pourrait être douloureux et, pour certains types de tumeurs, provoquer la libération de substances inflammatoires. Le port d’une collerette peut être nécessaire pour empêcher le chien de lécher la plaie.
Soins de support et accompagnement du carcinome mammaire
La prise en charge des tumeurs mammaires chez la chienne ne se limite pas au traitement chirurgical ou médical de la maladie. Les soins de support jouent un rôle fondamental pour préserver la qualité de vie de l’animal tout au long du parcours thérapeutique, et pour accompagner le propriétaire dans cette épreuve. Une approche globale, centrée sur le bien-être de la chienne, permet d’optimiser les résultats du traitement et d’atténuer les conséquences physiques et émotionnelles de la maladie.
Après une chirurgie ou lors de traitements adjuvants comme la chimiothérapie ou la radiothérapie, il est fréquent que la chienne présente des effets secondaires : fatigue, perte d’appétit, troubles digestifs, ou inconfort au niveau des tissus opérés. Un suivi attentif et des soins adaptés sont alors essentiels. L’alimentation doit être surveillée et, si besoin, adaptée pour soutenir l’organisme, favoriser la cicatrisation et maintenir un bon état nutritionnel. Des compléments alimentaires spécifiques ou des régimes enrichis peuvent être recommandés par le vétérinaire pour répondre aux besoins particuliers de l’animal atteint de tumeurs mammaires.
Le confort au quotidien est également une priorité. Il convient d’aménager l’environnement de la chienne pour limiter le stress et faciliter ses déplacements, surtout en cas de fatigue ou de douleurs. Des séances de physiothérapie ou de massages doux peuvent contribuer à améliorer la mobilité et à réduire les tensions musculaires, tout en renforçant le lien entre l’animal et son propriétaire.
L’accompagnement émotionnel ne doit pas être négligé. La maladie et les traitements peuvent générer de l’anxiété, tant chez la chienne que chez son maître. Un soutien psychologique, des moments de détente et de jeu, ainsi qu’une routine rassurante, participent à la stabilité émotionnelle de l’animal. Le vétérinaire, en tant que référent, joue un rôle clé pour conseiller, rassurer et orienter vers des solutions adaptées à chaque étape de la prise en charge.
Enfin, lorsque la maladie évolue vers une phase avancée ou que les options curatives ne sont plus envisageables, les soins palliatifs prennent le relais. L’objectif est alors de préserver la dignité et le confort de la chienne, en soulageant la douleur et en anticipant les complications. L’écoute et l’accompagnement du propriétaire sont alors primordiaux pour prendre les décisions les plus justes, dans le respect de la vie et du bien-être de l’animal.
En résumé, les soins de support sont indissociables d’une prise en charge réussie des tumeurs mammaires chez la chienne. Ils permettent d’améliorer le quotidien, de renforcer l’efficacité des traitements, et d’offrir à chaque animal une vie la plus sereine possible, malgré la maladie.
Conclusion
En synthèse, les tumeurs mammaires chez la chienne constituent une affection oncologique prépondérante dont la gravité potentielle impose une approche rigoureuse et proactive. L’étiologie est dominée par l’influence hormonale, ce qui fait de la stérilisation précoce la mesure de prévention la plus efficace et un enjeu de santé publique vétérinaire. La démarche clinique repose sur un diagnostic précoce, idéalement par l’exérèse chirurgicale de toute masse suspecte, suivie d’une analyse histopathologique systématique. Cette dernière, couplée au bilan d’extension, permet de définir un pronostic précis qui dépend de facteurs bien établis comme la taille tumorale, le grade histologique et le statut métastatique. La chirurgie d’exérèse large reste le pilier du traitement, pouvant être complétée par des thérapies adjuvantes dans les cas à haut risque.
La recherche sur la tumeur mammaire canine est un domaine dynamique qui ouvre des perspectives prometteuses, non seulement pour la santé animale mais aussi humaine, dans le cadre du concept “One Health”. Plusieurs axes de recherche futurs méritent une attention particulière :
-
Standardisation des protocoles thérapeutiques : Il subsiste un besoin criant d’essais cliniques prospectifs, randomisés et à grande échelle pour établir de manière définitive l’efficacité des différents protocoles de chimiothérapie et de radiothérapie adjuvantes. De telles études permettraient d’harmoniser les pratiques et d’optimiser la prise en charge des cas à haut risque.
-
Développement de thérapies ciblées et d’immunothérapies : L’avenir de l’oncologie réside dans la médecine de précision. La recherche doit s’intensifier pour identifier des biomarqueurs fiables et développer des thérapies spécifiquement adaptées au chien. Cela inclut les inhibiteurs de voies de signalisation (comme les inhibiteurs de mTOR ou de tyrosine kinases) et les immunothérapies (inhibiteurs de points de contrôle immunitaires, thérapies cellulaires CAR-T, virus oncolytiques), qui offrent l’espoir de traitements plus efficaces avec moins d’effets secondaires.
-
Approfondissement de l’oncologie comparative : Le chien est un modèle spontané exceptionnel pour le cancer du sein humain. Les futures recherches devraient pleinement exploiter ce potentiel en intégrant les essais cliniques canins dans le paysage de la recherche sur le cancer humain. Cela passe par l’étude des facteurs de risque environnementaux partagés et par la génomique comparative pour découvrir de nouvelles cibles thérapeutiques bénéfiques aux deux espèces.
-
Génomique et prédisposition raciale : Des études génomiques plus poussées sont nécessaires pour élucider les bases moléculaires de la prédisposition observée dans certaines races. L’identification des gènes de susceptibilité pourrait, à terme, mener au développement de tests de dépistage génétique et à l’élaboration de programmes d’élevage visant à réduire l’incidence de cette maladie.
Références
-
Sorenmo, K. U., Rasotto, R., Zappulli, V., & Goldschmidt, M. H. (2013). Development, anatomy, and physiology of the mammary gland. In Canine and Feline Oncology (pp. 615-624). Elsevier.
-
Salas, Y., Márquez, A., Diaz, D., & Romero, L. (2015). Epidemiological study of mammary tumors in female dogs diagnosed during the period 2002-2012: a growing animal health problem. PLoS One, 10(5), e0127381.
-
Schneider, R. (1970). Comparison of age, sex, and incidence rates in human and canine breast cancer. Cancer, 26(2), 419-426.
-
Goldschmidt, M., Peña, L., Rasotto, R., & Zappulli, V. (2011). Classification and grading of canine mammary tumors. Veterinary Pathology, 48(1), 117-131.
-
Sleeckx, N., de Rooster, H., Veldhuis Kroeze, E. J., Van Ginneken, C., & Van Brantegem, L. (2011). Canine mammary tumours, an overview. Reproduction in Domestic Animals, 46(6), 1112-1131.
-
Sorenmo, K. U., Worley, D. R., & Goldschmidt, M. H. (2013). Tumors of the mammary gland. In S. J. Withrow, D. M. Vail, & R. L. Page (Eds.), Withrow & MacEwen’s Small Animal Clinical Oncology (5th ed., pp. 538-556). Elsevier Saunders.
-
Egenvall, A., Bonnett, B. N., Ohagen, P., Olson, P., Hedhammar, A., & von Euler, H. (2005). Incidence of and survival after diagnosis of mammary tumors in a population of over 80,000 insured female dogs in Sweden from 1995 to 2002. Preventive Veterinary Medicine, 69(1-2), 109-127.
-
Peña, L., Gama, A., Goldschmidt, M. H., Abadie, J., Benazzi, C., Castagnaro, M.,… & Martín de las Mulas, J. (2014). Canine mammary tumors: a review and consensus of standard guidelines on epithelial and myoepithelial phenotype markers, HER2, and hormone receptor assessment using immunohistochemistry. Veterinary Pathology, 51(1), 127-145.
-
Cassali, G. D., Lavalle, G. E., De Nardi, A. B., Ferreira, E., Bertagnolli, A. C., Estrela-Lima, A.,… & Cassali, G. D. (2017). Consensus for the diagnosis, prognosis and treatment of canine mammary tumors. Brazilian Journal of Veterinary Pathology, 10(2), 49-69.
-
Tran, C. M., Moore, A. S., & Frimberger, A. E. (2016). Surgical treatment of canine mammary tumours: a systematic review. Veterinary and Comparative Oncology, 14(2), 147-160.
-
Guil-Luna, S., Millán, Y., de Andrés, F., Rey-Castaño, M., O’Connor, J. E., & Martín de las Mulas, J. (2011). Aglepristone decreases proliferation in progesterone receptor-positive canine mammary carcinomas. Reproduction in Domestic Animals, 46(5), 857-863.
-
Karayannopoulou, M., Tsioli, V., Fytianou, A., Koutinas, A. F., & Polizopoulou, Z. S. (2009). Adjuvant post-operative chemotherapy in bitches with mammary cancer. Journal of Veterinary Medicine Series A, 52(4), 214-220.
-
Simon, D., Schoenrock, D., Baumgärtner, W., & Nolte, I. (2009). Postoperative adjuvant treatment of invasive malignant mammary gland tumors in dogs with doxorubicin. Journal of Veterinary Internal Medicine, 23(5), 1134-1140.
-
Marconato, L., Romanelli, G., Stefanello, D., & Zini, E. (2009). Prognostic factors for dogs with mammary inflammatory carcinoma: 43 cases (2003-2008). Journal of the American Veterinary Medical Association, 235(8), 967-972.
-
de la Rua, R. D., Salas, Y., & Márquez, A. (2020). Canine mammary cancer: state of the art and future perspectives. Animals, 10(10), 1910.
-
Burrai, G. P., Tilocca, B., Leoni, G. G., Sini, M. C., & Antuofermo, E. (2020). Age and tumor size are predictors of malignancy in canine mammary tumors. Animals, 10(10), 1867.
-
Rasotto, R., Berlato, D., Goldschmidt, M. H., & Zappulli, V. (2017). A retrospective study of 122 cases of canine inflammatory mammary carcinoma: clinical, microscopic and immunohistochemical features. Veterinary and Comparative Oncology, 15(3), 873-884.
-
Araújo, M. R., Guedes, M. I., Pires, I., & de Matos, A. (2022). Canine mammary tumors as a promising adjunct preclinical model for human breast cancer research: similarities, opportunities, and challenges. Cancers, 14(15), 3745.
Recherches Connexes
tumeurs mammaires chien, conduite, prévalence, vaisseaux lymphatiques, apparition, moitié, pr, sujet, paris, ablation
tumeurs mammaires chien
