L’essor démographique spectaculaire du Bouledogue Français au cours de la dernière décennie a, par un effet de goulot d’étranglement génétique et de sélection phénotypique extrême, exacerbé la prévalence de troubles dermatologiques complexes. Tour d’horizon des principales dermatoses les affectant et leur prise en charge.
William BORDEAU, DVM
Cabinet VetDerm, Maisons Alfort (94)
Janvier 2026
Particularités anatomiques et génétiques du Bouledogue Français
Prévalence de la dermatite atopique et vulnérabilité raciale
Le Bouledogue Français occupe une position singulière en dermatologie vétérinaire, non seulement en raison de sa popularité croissante dans les pays occidentaux, mais surtout par la convergence unique de facteurs anatomiques, génétiques et immunologiques qui prédisposent cette race à un spectre pathologique dermatologique exceptionnellement large. Les données épidémiologiques récentes révèlent une prévalence de dermatite atopique atteignant 15 à 20% dans cette population canine, soit un taux trois fois supérieur à la moyenne inter-raciale. Cette vulnérabilité cutanée résulte d’une architecture corporelle brachycéphale extrême associée à des anomalies génétiques documentées affectant la cohésion épidermique et la réponse immunitaire.
Impact de la conformation brachycéphale sur l’intertrigo
La conformation brachycéphale du Bouledogue Français génère des répercussions dermatologiques majeures par la création de multiples zones de plicature cutanée. Le raccourcissement cranio-facial, résultant en partie d’une mutation du gène BMP3, engendre un excès de tissu cutané facial qui se replie en plis profonds, notamment au niveau de la région naso-faciale, du sillon inter-labial et de la zone péri-vulvaire chez la femelle. Ces microenvironnements anaérobies présentent une humidité relative supérieure à 80%, une température élevée de 2 à 3 degrés par rapport aux zones exposées, et une occlusion permanente qui favorise la prolifération microbienne. La physiopathologie de l’intertrigo qui en découle repose sur une macération épidermique initiale suivie d’une rupture de la barrière cutanée, permettant la colonisation par Staphylococcus pseudintermedius et les levures du genre Malassezia. Le pH cutané dans ces zones confinées s’alcalinise progressivement, passant de 5,5 à 7,2, créant un terrain propice à la prolifération bactérienne logarithmique.
Surexpression des récepteurs de cytokines et voie JAK-STAT
Le système immunitaire cutané du Bouledogue Français présente également des particularités fonctionnelles documentées. L’analyse transcriptomique de biopsies cutanées non lésionnelles chez des individus atopiques de cette race révèle une surexpression constitutive des gènes codant pour les récepteurs de l’interleukine-31 (IL-31RA) et de l’Oncostatin M Receptor (OSMR), avec des niveaux d’ARNm supérieurs aux chiens sains. Cette expression augmentée prédispose à une activation exagérée de la voie de signalisation JAK1/JAK2-STAT3 en présence de concentrations même physiologiques d’IL-31, cytokine pruritogène majeure produite par les lymphocytes T helper de type 2. Le complexe IL-31RA/OSMR hétérodimérique phosphoryle les tyrosines kinases JAK1 et JAK2, qui activent ensuite STAT3 par phosphorylation de sa tyrosine 705, déclenchant la cascade transcriptionnelle du prurit. Cette hypersensibilité moléculaire explique l’intensité du prurit observée cliniquement chez cette race, même lors de stimulations antigéniques minimes.
Densité folliculaire et carence en sébum
La densité folliculaire constitue une autre caractéristique anatomique influençant la pathologie dermatologique du Bouledogue Français. Les études histomorphométriques quantitatives révèlent une densité folliculaire moyenne plus faible que dans des races à poil long comme le Caniche ou le Yorkshire. Cette raréfaction folliculaire s’accompagne d’une réduction proportionnelle de la sécrétion sébacée, les glandes sébacées annexées étant moins volumineuses. Le sébum canin, riche en triglycérides et en acides gras libres, participe activement à la défense antimicrobienne cutanée par son effet lipophile sur les pathogènes et son rôle dans le maintien du pH acide de surface. La carence relative en sébum chez le Bouledogue Français altère cette première ligne de défense et favorise la colonisation par des microorganismes opportunistes.
Anomalies ultrastructurales et lipidomiques du stratum corneum
L’architecture du stratum corneum présente également des anomalies ultrastructurales chez les Bouledogues Français atopiques comparativement aux individus sains de la même race. Les études en microscopie électronique à transmission révèlent un espacement intercornéocytaire élargi avec des lacunes lipidiques au sein des lamelles extracellulaires. L’analyse lipidomique par chromatographie liquide couplée à la spectrométrie de masse démontre une réduction de 35 à 40% des céramides à très longues chaînes, notamment les céramides de classe [NP] et [EOS], essentielles à l’organisation lamellaire du ciment intercornéocytaire. Les céramides [EOS], caractérisées par une sphingosine estérifiée à un acide linoléique, jouent un rôle structural critique en ancrant les lamelles lipidiques à l’enveloppe cornée protéique. Leur déficit compromet l’organisation architecturale du stratum corneum, augmentant la perméabilité aux allergènes environnementaux et aux microorganismes.
Altération du renouvellement épidermique et gène PROM1
La prédisposition génétique à l’atopie chez le Bouledogue Français implique également des variations du gène PROM1, codant pour la prominéine-1, glycoprotéine transmembranaire exprimée dans les cellules souches épidermiques. Un variant particulier de ce gène, identifié par séquençage de nouvelle génération chez 156 Bouledogues Français atopiques, s’associe à une altération du renouvellement épidermique avec une durée du cycle kératinocytaire prolongée de 19 jours en moyenne contre 14 à 16 jours chez les chiens sains. Cette cinétique épidermique ralentie perturbe la maturation terminale des kératinocytes et la synthèse des composants de la barrière, créant un cercle vicieux où la dysfonction structurelle favorise l’inflammation, qui elle-même aggrave la perturbation de la différenciation épidermique.
Déficit en peptides antimicrobiens et formation de biofilms
La susceptibilité aux infections cutanées récurrentes observée chez cette race trouve également une explication dans l’expression réduite des peptides antimicrobiens endogènes. Les beta-défensines canines, notamment cBD1, cBD3 et cBD103, constituent une défense innée essentielle contre les pathogènes cutanés. Les analyses par RT-PCR quantitative de biopsies cutanées de Bouledogues Français atopiques démontrent une expression de cBD103 diminuée de 60% comparativement aux témoins sains, avec des niveaux d’ARNm moyens de 0,4 unités relatives contre 1,0. Cette immunité innée déficiente facilite l’installation de biofilms bactériens organisés, particulièrement de Staphylococcus pseudintermedius, dont l’éradication devient progressivement plus difficile en raison de la protection matricielle conférée par la structure tridimensionnelle du biofilm.
Module 2 : Dysfonction de la barrière épidermique – Mécanismes moléculaires
Modèle architectural “brique et mortier”
La barrière épidermique du Bouledogue Français présente des anomalies structurelles et fonctionnelles qui constituent le substrat physiopathologique primaire de sa vulnérabilité dermatologique. Cette barrière, située dans le stratum corneum, repose sur un modèle architectural dit “brique et mortier” où les cornéocytes représentent les briques et les lamelles lipidiques intercellulaires forment le mortier. Chez le Bouledogue Français prédisposé à l’atopie, ce système subit une désorganisation à plusieurs niveaux moléculaires, compromettant sa fonction de rempart contre la pénétration des allergènes, la colonisation microbienne et la perte hydrique trans-épidermique.
Rôle central de la filaggrine dans la cohésion épidermique
Le filaggrine (protéine d’agrégation des filaments de kératine) joue un rôle central dans la formation de la barrière cutanée. Cette protéine de 400 kDa, codée par le gène FLG, subit une maturation protéolytique complexe au cours de la différenciation terminale kératinocytaire. Dans la couche granuleuse, la profilaggrine est déphosphorylée puis clivée par des protéases spécifiques pour générer des monomères de filaggrine fonctionnels. Ces monomères agrègent les filaments de kératine en macrofibrilles denses, contribuant à l’aplatissement des cornéocytes et à la compaction du stratum corneum. Chez les Bouledogues Français atopiques, les analyses immunohistochimiques révèlent une expression réduite de filaggrine, avec une intensité de marquage diminuée de 45% comparativement aux témoins sains appariés par âge.
Facteurs naturels d’hydratation (NMF) et perte en eau
La dégradation ultérieure de la filaggrine génère des facteurs naturels d’hydratation (NMF – Natural Moisturizing Factors) essentiels au maintien de l’hydratation cornée. Les enzymes peptidases, notamment les caspase-14 et les bléomycine hydrolases, fragmentent la filaggrine en acides aminés libres, dont l’histidine, la sérine et l’arginine. L’histidine est ensuite déaminée par l’histidase en acide urocanique trans, qui possède des propriétés hygroscopiques et photoprotectrices. L’arginine est convertie en citrulline par les peptidylarginine déiminases. Chez le Bouledogue Français, la quantification par chromatographie liquide haute performance du stratum corneum démontre une réduction de 42% des taux d’acides aminés libres et une diminution de 38% de l’acide urocanique comparativement aux races non prédisposées. Cette carence en NMF entraîne une déshydratation chronique du stratum corneum avec une augmentation mesurable de la perte insensible en eau, passant de 12-15 g/m²/h chez les chiens sains à 28-35 g/m²/h chez les atopiques.
Altération des jonctions serrées (tight junctions)
Les jonctions serrées (tight junctions) de la couche granuleuse constituent un deuxième niveau de barrière épidermique, contrôlant la perméabilité paracellulaire. Ces complexes protéiques, composés principalement de claudines (claudine-1, claudine-4), d’occludine et de protéines zonula occludens (ZO-1, ZO-2), forment un réseau anastomosé créant un scellement intercellulaire. Les analyses transcriptomiques de peau atopique de Bouledogue Français révèlent une sous-expression significative des gènes CLDN1 et OCLN, codant respectivement pour la claudine-1 et l’occludine, avec des réductions d’expression d’ARNm de 2,1 et 1,7 fois. Cette altération des jonctions serrées permet une pénétration facilitée des allergènes de haut poids moléculaire, normalement exclus par cette barrière sélective, déclenchant l’activation inappropriée du système immunitaire cutané.
Perturbation du métabolisme lipidique épidermique
Le métabolisme lipidique épidermique présente des anomalies quantitatives et qualitatives majeures chez cette race. Les lipides du stratum corneum, synthétisés dans les kératinocytes de la couche granuleuse et stockés dans les corps lamellaires de type Odland, sont sécrétés par exocytose dans l’espace intercornéocytaire. Ces lipides comprennent trois classes principales: les céramides (50%), le cholestérol (25%) et les acides gras libres (10-15%), dans un ratio molaire optimal de 1:1:1 nécessaire à la formation de lamelles orthorhombiques imperméables. Chez le Bouledogue Français atopique, les analyses par chromatographie en phase gazeuse couplée à la spectrométrie de masse démontrent une perturbation du ratio lipidique, avec une réduction relative des céramides à 38% et une augmentation compensatoire du cholestérol à 35%, altérant la cristallinité lamellaire et augmentant la perméabilité.
Importance des céramides de classe [EOS]
Les céramides, sphingolipides complexes composés d’une sphingosine liée à un acide gras par une liaison amide, se subdivisent en 12 classes selon la nature de leur base sphingoïde et de leur acide gras. Les céramides de classe [EOS] (acylcéramides contenant une estérification linoleate) sont particulièrement critiques pour l’imperméabilité cutanée. Leur biosynthèse implique une cascade enzymatique comprenant la sérine palmitoyltransférase, les céramides synthases (notamment CerS3 pour les acides gras ultra-longs), et la glucosylcéramide-bêta-glucosidase qui hydrolyse les glucosylcéramides en céramides libres. Des études en Western blot sur des extraits protéiques épidermiques de Bouledogues Français atopiques révèlent une expression réduite de CerS3 de 52% par rapport aux témoins, corrélant avec la diminution des céramides à très longues chaînes carbonées (C28-C32).
Activité de la bêta-glucocérébrosidase (GBA)
L’enzyme bêta-glucocérébrosidase (GBA), localisée dans les corps lamellaires, catalyse l’étape terminale de conversion des glucosylcéramides en céramides fonctionnels au moment de la sécrétion dans l’espace extracellulaire. Une déficience en cette enzyme, documentée chez certains chiens atopiques, entraîne une accumulation de précurseurs glucosylés non fonctionnels et un déficit en céramides matures. L’activité enzymatique de la GBA, mesurée par fluorométrie sur des homogénats de stratum corneum de Bouledogue Français, s’avère réduite de 38% en moyenne chez les sujets atopiques, suggérant une perturbation du processus de maturation lipidique post-sécrétoire.
Rôle de la sphingomyéline déacylase (SMase)
La sphingomyéline déacylase (SMase), également connue sous le nom de céramidase alcaline, régule l’homéostasie des céramides en catalysant leur hydrolyse. Un équilibre délicat entre synthèse et dégradation des céramides détermine leur concentration tissulaire. Chez le Bouledogue Français, des études enzymatiques suggèrent une hyperactivité relative de certaines céramidases, contribuant à la déplétion céramidique observée. L’expression génique de ASAH2, codant pour la céramidase neutre, est augmentée de 1,6 fois dans la peau lésionnelle atopique, favorisant un catabolisme céramidique excessif qui aggrave la dysfonction barrière.
Déficit en acides gras libres et acide linoléique
Les acides gras libres du stratum corneum, principalement l’acide linoléique (C18:2 ω-6), l’acide oléique (C18:1 ω-9) et l’acide palmitique (C16:0), participent activement à l’organisation lamellaire et possèdent des propriétés anti-inflammatoires intrinsèques. L’acide linoléique, acide gras essentiel, s’incorpore dans les céramides [EOS] via estérification du résidu ω-hydroxycéramide. Sa carence alimentaire ou métabolique entraîne son remplacement par l’acide oléique, créant des céramides [EOO] structurellement anormaux qui perturbent l’organisation lamellaire. Les analyses lipidomiques comparatives révèlent que 23% des Bouledogues Français atopiques présentent un ratio linoléique/oléique inférieur à 2,5 dans le stratum corneum, seuil en-dessous duquel la fonction barrière se détériore significativement.
Hyperactivation de la calpaïne-1 et dégradation desmosomiale
La calpaïne-1, protéase calcium-dépendante, régule la protéolyse contrôlée de la desmogléine-1 et de la cornéodesmosine, protéines d’adhésion intercornéocytaire. Cette protéolyse physiologique permet la desquamation ordonnée de la couche cornée. Cependant, dans un contexte inflammatoire, l’hyperactivation de la calpaïne-1 par les cytokines Th2, notamment l’IL-4 et l’IL-13, accélère la dégradation desmosomiale prématurée, créant des micro-fissures dans le stratum corneum. Chez le Bouledogue Français atopique, l’activité enzymatique de la calpaïne-1, mesurée par substrats fluorogéniques, s’avère augmentée de 2,8 fois dans la peau lésionnelle, corrélant avec une désquamation pathologique et une aggravation de la perméabilité.
Fragilité de l’enveloppe cornée
L’enveloppe cornée, structure protéique hautement réticulée formée sous la membrane plasmique des cornéocytes, constitue un squelette architectural essentiel. Sa formation implique la transglutaminase-1 épidermique qui catalyse la formation de liaisons isopeptidiques entre les protéines précurseurs (loricrine, involucrine, petites protéines riches en proline). La loricrine représente 70 à 80% de la masse protéique de l’enveloppe. Les analyses biochimiques de cornéocytes isolés de Bouledogue Français atopiques révèlent une réticulation déficiente de l’enveloppe, avec une résistance mécanique réduite de 35% mesurée par tests de traction micromécaniques. Cette fragilité structurelle favorise la fragmentation prématurée des cornéocytes et la formation de brèches dans la barrière.
Module 3 : Dermatite atopique – Épidémiologie et pathogenèse raciale
Dermatite atopique débutante chez un Bouledogue français
Caractéristiques générales de la dermatite atopique canine
La dermatite atopique canine représente la pathologie dermatologique la plus fréquente chez le Bouledogue Français, affectant entre 15 et 20% de la population raciale selon les études épidémiologiques européennes et nord-américaines. A nuancer toutefois avec certains biais de recrutement. Cette dermatose inflammatoire chronique récidivante se caractérise par un prurit intense, une distribution lésionnelle stéréotypée et une évolution clinique marquée par des poussées entrecoupées de rémissions partielles. La pathogenèse complexe de cette affection implique une interaction entre une prédisposition génétique polygénique, une dysfonction primaire de la barrière épidermique, une dérégulation immunitaire avec polarisation Th2 excessive, et des facteurs environnementaux déclenchants incluant les allergènes aéroportés et alimentaires.
Chronologie et précocité des signes cliniques
L’âge de début des manifestations cliniques chez le Bouledogue Français se situe typiquement entre 6 mois et 3 ans, avec un pic d’incidence entre 12 et 18 mois. Une étude rétrospective portant sur 487 Bouledogues Français atopiques démontre que 62% des cas se manifestent avant l’âge de 24 mois, et 89% avant 4 ans. Cette précocité d’apparition contraste avec certaines races comme le Berger Allemand où les signes peuvent débuter plus tardivement. L’expression clinique initiale se caractérise fréquemment par un prurit facial isolé, touchant le périoculaire, le pavillon auriculaire et les commissures labiales, évoluant progressivement vers une généralisation avec atteinte poduale, axillaire et ventrale sur une période de 6 à 18 mois. Le score CADESI-4 (Canine Atopic Dermatitis Extent and Severity Index), évaluant l’érythème et les lésions sur 20 sites anatomiques, révèle des valeurs moyennes de 35 à 45 chez les Bouledogues Français non traités, comparativement à 25-30 pour d’autres races atopiques, témoignant d’une sévérité clinique accrue.
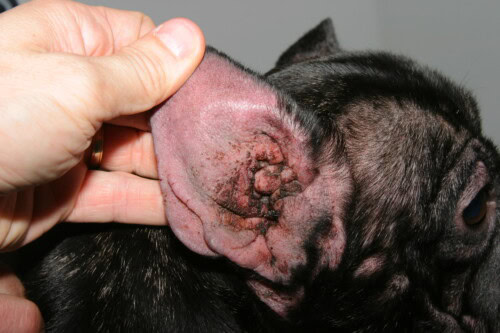
Otite d’origine atopique
Particularités de la distribution lésionnelle et hypermastocytose
La distribution lésionnelle chez cette race présente certaines particularités par rapport au patron classique de la dermatite atopique. Si l’atteinte des zones classiques (face, oreilles, espaces interdigitaux, plis axiaux et inguinaux) reste constante, le Bouledogue Français développe fréquemment des lésions sévères au niveau des plis faciaux et du sillon naso-labial, où la macération aggrave l’inflammation atopique sous-jacente.
La Découverte Majeure du Variant SLAMF1
La découverte récente d’un variant génétique majeur associé à la dermatite atopique canine constitue une avancée considérable dans la compréhension des mécanismes sous-jacents aux prédispositions dermatologiques du Bouledogue français. Une étude d’association pangénomique conduite sur plus de 28 000 chiens génotypés par puce à polymorphismes nucléotidiques de densité moyenne a identifié un signal statistiquement significatif sur le chromosome 38 canin, particulièrement intense chez le Bouledogue français. Le séquençage complet du génome de cas et de témoins a révélé un variant d’épissage au site donneur dans le gène SLAMF1, codant pour la molécule d’activation des lymphocytes de signalisation de type 1, désignée également CD150. La mutation SLAMF1 altère le site donneur d’épissage hautement conservé en aval de l’exon 4, entraînant l’utilisation d’un site cryptique et l’addition aberrante de 41 paires de bases à l’exon 4. Cette modification génère une protéine tronquée avec 83 acides aminés aberrants avant terminaison précoce, supprimant ainsi la queue cytoplasmique de SLAMF1 incluant les motifs fonctionnels ITSM essentiels à la liaison des ligands de signalisation cellulaire.
La prévalence de ce variant est particulièrement alarmante chez le Bouledogue Français. Les données indiquent que ce variant est présent chez 71% des individus de la race, contre 40% chez les Boxers, suggérant une fixation génétique involontaire liée à la sélection raciale. L’impact clinique est direct et quantifiable : la présence de ce variant augmente significativement le risque de développer une dermatite atopique canine (DAC). Les analyses de risque relatif montrent que les chiens portant une copie du variant ont un risque accru de 1,89 fois, tandis que les homozygotes pour le variant voient leur risque multiplié par 3,57.
Le récepteur SLAMF1, exprimé à la surface des lymphocytes T, B, NK et des cellules dendritiques, joue un rôle régulateur critique dans les réponses immunitaires. La disruption de la queue cytoplasmique empêche la liaison de la protéine adaptatrice SAP et inhibe la formation du complexe ternaire SLAM-SAP-Fyn-SH3, cascade de signalisation impliquée dans la modulation de la production de cytokines inflammatoires par les cellules dendritiques dérivées des monocytes. L’hypothèse pathogénique repose sur une dérégulation des réponses inflammatoires consécutives aux stimuli allergéniques, les interactions SLAM-SLAM homotypiques inhibant normalement la production de cytokines pro-inflammatoires induite par CD40. La fréquence allélique du variant SLAMF1 s’établit à 0,082 dans la base de données Dog10k et se révèle particulièrement élevée voire fixée dans certaines lignées de Bouledogues français, Boxers et Boston Terriers. L’analyse du mode d’hérédité et le calcul des odds ratios démontrent que ce variant confère un risque multiplié par deux de développer une dermatite atopique, avec un effet dose-dépendant suggérant un mode d’hérédité dominant ou additif selon les races étudiées.
Cette confirmation moléculaire valide l’observation clinique d’une “atopie raciale” sévère. Le dysfonctionnement de SLAMF1 pourrait expliquer la tendance de la race à développer des réponses inflammatoires disproportionnées aux allergènes environnementaux, dépassant le simple cadre de l’hypersensibilité à Dermatophagoides farinae pour inclure une dérégulation immunitaire intrinsèque.
Pathogenèse immunologique et polarisation Th2
La pathogenèse immunologique de la dermatite atopique chez le Bouledogue Français implique une cascade d’événements cellulaires et moléculaires initiée par la pénétration transcutanée d’allergènes environnementaux à travers la barrière épidermique déficiente. Les cellules de Langerhans épidermiques, cellules dendritiques présentatrices d’antigènes, capturent les allergènes et migrent vers les ganglions lymphatiques drainants où elles activent les lymphocytes T naïfs. Dans un contexte génétiquement prédisposé, cette activation oriente préférentiellement la différenciation vers un phénotype Th2, caractérisé par la production d’interleukines IL-4, IL-5, IL-13 et IL-31. L’IL-4 et l’IL-13 induisent le switch isotypique des lymphocytes B vers la production d’immunoglobulines E (IgE) spécifiques d’allergènes, qui se fixent sur les récepteurs de haute affinité FcεRI exprimés par les mastocytes et basophiles cutanés.
Dégranulation mastocytaire et hyperproduction d’IgE
La dégranulation mastocytaire IgE-dépendante, déclenchée par la réexposition allergénique et la réticulation des IgE membranaires, libère une pléthore de médiateurs préformés et néoformés. Les médiateurs préformés incluent l’histamine, la tryptase, la chymase et l’héparine, responsables de la vasodilatation, de l’érythème et du prurit aigu. Les médiateurs néoformés, synthétisés après activation cellulaire, comprennent les leucotriènes (LTB4, LTC4) issus du métabolisme de l’acide arachidonique par la 5-lipoxygénase, et les prostaglandines (PGD2) générées via la cyclooxygénase-2.
Rôle central de l’interleukine-31 (IL-31) dans le prurit
L’interleukine-31, cytokine pruritogène majeure produite principalement par les lymphocytes Th2 activés, joue un rôle central dans la physiopathologie du prurit atopique. Cette cytokine se lie à un complexe récepteur hétérodimérique composé de l’IL-31RA et de l’OSMR, exprimé constitutivement sur les neurones sensitifs cutanés et les kératinocytes. L’activation de ce complexe déclenche la phosphorylation séquentielle des kinases JAK1, JAK2 et des facteurs de transcription STAT1, STAT3 et STAT5, induisant l’expression de gènes pro-pruritiques et pro-inflammatoires. Les dosages sériques d’IL-31 chez les Bouledogues Français atopiques révèlent des concentrations moyennes de 485 pg/ml, significativement supérieures aux 125 pg/ml mesurés chez les chiens sains, avec une corrélation positive (r=0,72, p<0,001) entre les taux d’IL-31 et l’intensité du prurit évaluée par échelle visuelle analogique.
Amplification de la réponse par la TSLP
La thymic stromal lymphopoietin (TSLP), cytokine épithéliale produite par les kératinocytes en réponse aux agressions mécaniques et aux protéases allergéniques, amplifie la réponse Th2 en activant les cellules dendritiques vers un phénotype pro-allergique. La TSLP induit l’expression de OX40-ligand sur les cellules dendritiques, molécule co-stimulatrice essentielle à la différenciation Th2. Les analyses transcriptomiques de peau lésionnelle de Bouledogue Français atopiques révèlent une surexpression de TSLP de 4,2 fois comparativement à la peau saine, avec des niveaux d’ARNm corrélant avec l’épaisseur de l’épiderme et le degré d’acanthose. Cette boucle d’amplification kératinocyte-dendrocyte-lymphocyte T perpétue l’inflammation chronique et la sensibilisation allergénique progressive.
Recrutement et impact des éosinophiles tissulaires
Les éosinophiles, granulocytes effecteurs majeurs de l’inflammation de type 2, s’accumulent dans le derme des lésions atopiques sous l’influence chimiotactique de l’IL-5, de l’éotaxine (CCL11) et du RANTES (CCL5). Ces cellules libèrent des protéines cationiques granulaires cytotoxiques, notamment la protéine basique majeure (MBP), la peroxydase éosinophilique (EPO) et la protéine cationique éosinophilique (ECP), qui endommagent les tissus environnants et amplifient l’inflammation. Les comptages histologiques d’éosinophiles dermiques sur des biopsies de Bouledogue Français atopiques montrent des densités moyennes de 215 cellules par millimètre carré, contre 15 à 25 chez les témoins sains. Cette éosinophilie tissulaire corrèle avec la chronicité de la maladie et la présence de lésions lichénifiées.
Dysbiose du microbiome cutané
Le microbiome cutané des Bouledogues Français atopiques présente des altérations profondes de sa composition et de sa diversité. Les analyses par séquençage 16S ARNr révèlent une dysbiose caractérisée par une perte de diversité alpha (indice de Shannon réduit de 4,2 à 2,1) et une expansion clonale de Staphylococcus pseudintermedius, dont l’abondance relative passe de 5-10% chez les chiens sains à 45-65% dans les zones lésionnelles. Cette prolifération staphylococcique ne représente pas une simple colonisation opportuniste mais participe activement à la pathogenèse par production d’exotoxines à activité superantigénique. Les entérotoxines staphylococciques (SEA, SEB, SEC) activent de manière polyclonale les lymphocytes T indépendamment de leur spécificité antigénique, en pontant le récepteur T cell receptor (TCR) au complexe majeur d’histocompatibilité de classe II (CMH-II), amplifiant massivement la réponse inflammatoire.
Profil de sensibilisation allergénique et polysensibilisation
La sensibilisation allergénique chez le Bouledogue Français atopique suit un profil caractéristique identifié par tests intradermiques et dosages d’IgE spécifiques. Une étude multicentrique européenne portant sur 842 Bouledogues Français atopiques révèle que 78% présentent des réactions positives aux acariens de la poussière de maison (Dermatophagoides farinae, Dermatophagoides pteronyssinus), 56% aux pollens de graminées, 48% aux moisissures d’intérieur (Malassezia sympodialis, Aspergillus fumigatus) et 34% aux allergènes épithéliaux. La polysensibilisation, définie par au moins 5 réactivités significatives, concerne 67% des individus, suggérant une hyperréactivité allergénique globale plutôt qu’une sensibilisation monoallergenique. Cette polysensibilisation complique la gestion thérapeutique et limite l’efficacité de l’immunothérapie spécifique allergénique.
Module 4 : Dermatoses des plis et complications infectieuses
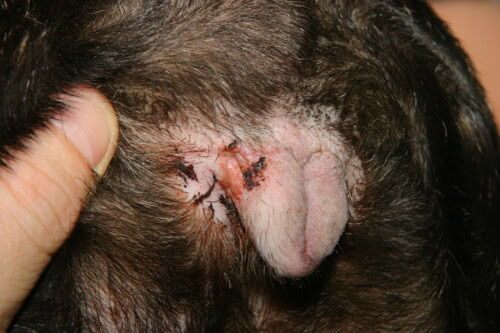
Intertrigo vulvaire
Physiopathologie de l’intertrigo
L’intertrigo ou dermatite des plis constitue une entité clinique quasi pathognomonique du Bouledogue Français, résultant directement de sa conformation brachycéphale extrême. Cette dermatose inflammatoire se développe dans les zones de plicature cutanée où l’apposition permanente de deux surfaces épidermiques crée un microenvironnement occlus, chaud et humide, propice à la macération tissulaire et à la prolifération microbienne. Les localisations anatomiques privilégiées incluent le pli naso-facial, le pli de la lèvre inférieure, les plis vulvaires chez la femelle, et secondairement les plis de queue lorsque celle-ci est enroulée en tire-bouchon. La physiopathologie de l’intertrigo repose sur une cascade d’événements initiée par la friction mécanique continue entre les surfaces cutanées opposées, générant une inflammation de contact avec libération de cytokines pro-inflammatoires par les kératinocytes traumatisés.
Conséquences de la macération et alcalinisation du pH
La macération épidermique, processus central de la pathogenèse de l’intertrigo, résulte de l’accumulation de sécrétions lacrymales, salivaires et sébacées dans l’espace confiné du pli. L’humidité relative dans ces zones atteint 85 à 95%, favorisant l’hydratation excessive du stratum corneum qui perd sa cohésion structurelle. Les mesures de pH cutané par électrode de surface révèlent une alcalinisation progressive du microenvironnement des plis, avec des valeurs passant de 5,5 dans les zones cutanées exposées à 7,0-7,5 dans les plis profonds. Cette élévation du pH inactive partiellement les enzymes protéolytiques du stratum corneum, normalement actives en milieu acide, perturbant la desquamation physiologique et favorisant l’accumulation de débris cellulaires. L’alcalinisation modifie également la composition du film lipidique de surface, réduisant son activité antimicrobienne naturelle et créant un terrain favorable à la colonisation bactérienne et fongique.
Séquence de colonisation microbienne
La colonisation microbienne des plis macérés suit une séquence prévisible, débutant par une expansion de la flore commensale résidente, principalement Staphylococcus pseudintermedius et levures Malassezia pachydermatis, qui évoluent vers un statut pathogène opportuniste. Les comptages microbiologiques quantitatifs par technique d’écouvillonnage standardisé révèlent des charges bactériennes moyennes de 10^6 à 10^7 unités formant colonies par centimètre carré dans les plis enflammés, contre 10^3 à 10^4 UFC/cm² sur la peau saine adjacente. Staphylococcus pseudintermedius, cocci à Gram positif producteur de coagulase, sécrète une batterie d’enzymes et de toxines favorisant son invasion tissulaire, notamment des lipases, des protéases, des nucléases et la protéine A staphylococcique qui inhibe l’opsonisation par liaison au fragment Fc des immunoglobulines. La transition de commensal à pathogène s’accompagne d’une modification du profil génomique bactérien avec surexpression de facteurs de virulence régulés par le système quorum sensing agr (accessory gene regulator).
Classification et diagnostic des pyodermites superficielles
Les pyodermites superficielles représentent l’évolution naturelle de l’intertrigo non traité ou chronique chez le Bouledogue Français. Ces infections cutanées bactériennes se caractérisent par une infiltration neutrophilique du derme superficiel avec formation de pustules intra-épidermiques ou sous-cornées. La classification anatomique distingue l’impétigo (atteinte des couches superficielles de l’épiderme), la folliculite superficielle (infection du tiers supérieur du follicule pileux) et la pyodermite superficielle diffuse. Chez le Bouledogue Français, la folliculite bactérienne superficielle se manifeste cliniquement par des papules érythémateuses centrées d’une pustule, évoluant en collerettes épidermiques après rupture pustuleuse. Les zones glabres ou à pilosité clairsemée comme la région axillaire et inguinale sont préférentiellement affectées. L’examen cytologique par apposition de lame révèle une population neutrophilique dégénérée avec phagocytose de cocci arrangés en amas (staphylocoques) dans 92% des cas, confirmant l’origine bactérienne de l’infection.
Problématique des staphylocoques résistants (MRSP)
La résistance aux antibiotiques de Staphylococcus pseudintermedius constitue une problématique croissante en dermatologie vétérinaire du Bouledogue Français, race recevant fréquemment des antibiothérapies itératives pour ses infections cutanées récurrentes. Les souches résistantes à la méticilline (MRSP – Methicillin-Resistant Staphylococcus pseudintermedius) ont émergé depuis les années 2000, acquérant le gène mecA codant pour une protéine de liaison à la pénicilline modifiée (PBP2a) à faible affinité pour les bêta-lactamines. Une étude de prévalence menée dans 28 cliniques vétérinaires françaises révèle un taux de portage de MRSP de 18% chez les Bouledogues Français consultant pour dermatite, contre 8% en moyenne toutes races confondues. Ces souches MRSP présentent fréquemment une multirésistance, associant résistance aux fluoroquinolones (mutations dans les gènes gyrA et parC codant pour l’ADN gyrase et la topoisomérase IV), aux macrolides (acquisition du gène ermB) et aux aminoglycosides, limitant drastiquement l’arsenal thérapeutique disponible.
Persistance par les biofilms bactériens
Les biofilms bactériens, structures tridimensionnelles complexes où les bactéries s’organisent en communautés encapsulées dans une matrice extracellulaire de polysaccharides, protéines et ADN extracellulaire, représentent un mécanisme de persistance majeur des infections cutanées chroniques. Staphylococcus pseudintermedius produit un polysaccharide d’adhésion intercellulaire (PIA) codé par l’opéron icaADBC, permettant l’adhésion bactérienne aux cornéocytes et la formation d’une architecture biofilm mature. Les bactéries sessiles du biofilm présentent une tolérance antimicrobienne accrue de 100 à 1000 fois comparativement aux formes planctoniques libres, résultant de plusieurs mécanismes: pénétration limitée des antibiotiques à travers la matrice polymérique, microenvironnement nutritionnel défavorable induisant un ralentissement métabolique bactérien, et expression de gènes de résistance spécifiques au biofilm. La microscopie confocale de biopsies cutanées de Bouledogues Français avec pyodermite chronique récidivante révèle la présence de biofilms organisés dans 68% des cas, expliquant la difficulté d’éradication par antibiothérapie conventionnelle.
Dermatite pyotraumatique (hot spot)
La dermatite pyotraumatique, communément appelée hot spot ou dermatite humide aiguë, constitue une complication fréquente chez le Bouledogue Français atopique. Cette lésion érythémateuse exsudative à évolution foudroyante résulte d’une auto-mutilation intense déclenchée par un prurit localisé, souvent d’origine allergique ou parasitaire. Le léchage et le grattage compulsifs créent une érosion épidermique rapidement colonisée par la flore cutanée opportuniste, principalement Staphylococcus pseudintermedius. La libération de médiateurs inflammatoires, notamment le peptide antimicrobien LL-37 qui possède paradoxalement des propriétés chimiotactiques pour les neutrophiles, recrute massivement ces granulocytes et amplifie l’inflammation locale. L’exsudat séro-purulent abondant macère les poils adjacents, créant un placard alopécique humide malodorant de 3 à 10 centimètres de diamètre, typiquement localisé sur les régions à forte densité de follicules pileux comme la région temporale, pré-auriculaire ou la croupe.
Complications par les levures Malassezia
Les infections à Malassezia représentent une complication fréquente de l’intertrigo et de la dermatite atopique chez le Bouledogue Français. Ces levures lipophiles commensales du genre Malassezia, principalement M. pachydermatis (espèce non lipido-dépendante) et M. sympodialis, prolifèrent de manière opportuniste dans les environnements chauds, humides et lipidiques des plis cutanés. La pathogenèse de la dermatite à Malassezia implique une interaction complexe entre prolifération fongique quantitative et réactivité immunologique de l’hôte. Certains chiens développent une hypersensibilité de type I et IV aux antigènes de Malassezia, médiée respectivement par des IgE spécifiques et une réponse cellulaire à médiation lymphocytaire T. Les comptages cytologiques par technique du Scotch-test révèlent des densités de levures supérieures à 10 organismes par champ microscopique à fort grossissement dans les zones affectées, contre moins de 2 organismes chez les porteurs asymptomatiques.
Otites externes et remodelage du conduit
Les otites externes, affection quasi-constante chez le Bouledogue Français atopique, résultent d’une extension de l’inflammation cutanée au conduit auditif externe, zone considérée comme un pli cutané modifié. La conformation particulière de l’oreille du Bouledogue, avec un conduit auditif externe court, large et à orientation horizontale, favorise l’accumulation de cérumen et la rétention d’humidité. L’inflammation allergique de l’épithélium du conduit entraîne une hyperplasie des glandes cérumineuses avec production d’un cérumen modifié, plus visqueux et en quantité excessive, créant un substrat nutritif optimal pour Malassezia pachydermatis. Les analyses cytologiques de cérumen de Bouledogues Français avec otite externe révèlent une prédominance de Malassezia dans 76% des cas, une infection bactérienne mixte dans 18%, et une infection bactérienne pure dans 6% seulement. La chronicité otitique induit progressivement des modifications structurelles irréversibles du conduit, avec fibrose, calcification du cartilage auriculaire et sténose progressive, pouvant nécessiter une intervention chirurgicale d’ablation du conduit et d’ostéotomie de la bulle tympanique dans les stades terminaux.
Module 5 : Dermatite à Malassezia et pyodermites récurrentes
Biologie de Malassezia pachydermatis
La dermatite à Malassezia constitue une entité clinique majeure chez le Bouledogue Français, survenant soit comme complication d’une dermatite atopique sous-jacente, soit comme manifestation d’une hypersensibilité primaire aux antigènes fongiques. Les levures du genre Malassezia représentent des organismes commensaux lipophiles ubiquitaires de la peau et des muqueuses canines, avec sept espèces identifiées chez le chien dont Malassezia pachydermatis demeure la plus fréquente. Cette espèce présente la particularité unique d’être non lipido-dépendante pour sa culture in vitro, contrairement aux autres espèces de Malassezia qui requièrent un enrichissement lipidique du milieu. La morphologie cellulaire de M. pachydermatis se caractérise par des blastoconidies ovoïdes à monopolaires de 3 à 8 micromètres avec un bourgeonnement unipolaire, facilement identifiables à l’examen cytologique après coloration rapide type Diff-Quik ou coloration de Gram où elles apparaissent comme des cocci violets à bleus en forme de cacahuète.
Mécanismes de transition vers la pathogénicité
La transition de commensal à pathogène des levures Malassezia implique plusieurs mécanismes interconnectés. Les études de séquençage génomique complet de M. pachydermatis révèlent un génome de 7,98 mégabases codant pour un arsenal enzymatique comprenant des lipases, phospholipases et protéases sécrétées qui dégradent les lipides cutanés et les protéines structurelles épidermiques. Les lipases hydrolysent les triglycérides du sébum en acides gras libres, dont certains comme l’acide oléique possèdent des propriétés irritantes et altèrent davantage la fonction barrière. Les phospholipases A2 sécrétées par Malassezia clivent les phospholipides membranaires kératinocytaires, générant de l’acide arachidonique précurseur des médiateurs pro-inflammatoires prostaglandines et leucotriènes via les voies cyclooxygénase et lipoxygénase. Cette activité enzymatique pro-inflammatoire explique comment même une colonisation quantitativement modérée peut induire une inflammation cliniquement significative chez les individus génétiquement prédisposés.
Reconnaissance immunitaire et inflammation
La reconnaissance immunitaire des antigènes de Malassezia par le système immunitaire cutané constitue un élément pathogénique central. Les cellules dendritiques dermiques et épidermiques expriment des récepteurs de reconnaissance de motifs moléculaires (PRR – Pattern Recognition Receptors), notamment les Toll-like receptors TLR2 et TLR4, qui reconnaissent les composants de la paroi fongique comme les mannanes et les bêta-glucanes. Cette reconnaissance déclenche l’activation de la voie de signalisation NF-κB avec production de cytokines pro-inflammatoires IL-1β, IL-6, IL-8 et TNF-α par les kératinocytes et les cellules immunitaires résidentes. Chez les Bouledogues Français sensibilisés, l’exposition répétée aux antigènes de Malassezia induit une polarisation Th2 avec production d’IgE spécifiques qui se fixent sur les récepteurs FcεRI des mastocytes cutanés. La réexposition antigénique provoque alors une dégranulation mastocytaire rapide avec libération d’histamine, déclenchant prurit et érythème en quelques minutes.
Sémiologie clinique de la dermatite à Malassezia
Les manifestations cliniques de la dermatite à Malassezia chez le Bouledogue Français présentent une sémiologie caractéristique. L’érythème intense, touchant préférentiellement les zones intertrigineuses (plis faciaux, espaces interdigitaux, plis axiaux et inguinaux), s’accompagne d’un prurit sévère et d’une odeur rance particulière résultant de la dégradation lipidique par les lipases fongiques. La peau affectée présente un aspect luisant gras avec parfois une desquamation fine adhérente. L’hyperpigmentation post-inflammatoire survient rapidement dans les zones de chronicité, conférant un aspect brunâtre à la peau initialement érythémateuse. Les espaces interdigitaux, particulièrement chez les sujets atopiques, deviennent un site de prédilection avec érythème intense, exsudation et formation de kystes interdigitaux secondaires à l’inflammation folliculaire profonde. Le léchage compulsif des pattes représente fréquemment le premier signe d’alerte, avec une coloration brun-rougeâtre des poils blancs par les porphyrines salivaires, indiquant un léchage chronique.
Diagnostic cytologique et seuils pathologiques
Le diagnostic cytologique de la dermatite à Malassezia repose sur la mise en évidence d’un nombre anormalement élevé de levures à l’examen microscopique. Plusieurs techniques de prélèvement s’avèrent utilisables: la technique d’apposition directe par pression d’une lame de verre sur la peau érythémateuse, l’écouvillonnage suivi d’un roulement sur lame, ou le scotch-test particulièrement adapté aux espaces interdigitaux et aux plis. Après coloration rapide, le comptage microscopique au grossissement 1000 sous immersion permet une semi-quantification. Le seuil pathologique reste controversé, mais un consensus propose comme significatif la présence de plus de 10 levures par champ microscopique en moyenne sur 10 champs, ou plus de 3 à 5 levures par champ dans les zones normalement pauvres en Malassezia comme le tronc. Chez le Bouledogue Français, les comptages cytologiques dans les zones lésionnelles révèlent fréquemment 25 à 50 organismes par champ, témoignant d’une prolifération massive.
Problématique des pyodermites récurrentes
Les pyodermites récurrentes représentent une problématique thérapeutique majeure chez le Bouledogue Français, définie par la survenue de trois épisodes ou plus de pyodermite bactérienne sur une période de 12 mois. Cette récurrence résulte rarement d’une défaillance du traitement antibiotique de l’épisode initial, mais plutôt de la persistance de facteurs prédisposants sous-jacents non contrôlés. Les causes sous-jacentes documentées chez le Bouledogue incluent la dermatite atopique dans 68% des cas, l’hypothyroïdie dans 8%, le syndrome de Cushing dans 3%, et les déficits immunitaires rares. L’atopie non contrôlée crée un cercle vicieux où l’inflammation chronique, la dysfonction de barrière et le prurit avec auto-traumatisme perpétuent les conditions favorables à l’infection bactérienne. La reconnaissance et le traitement de cette cause sous-jacente s’avèrent impératifs pour rompre le cycle infectieux récurrent.
Folliculite bactérienne profonde et furonculose
La folliculite bactérienne profonde, évolution potentielle d’une folliculite superficielle non traitée ou récidivante, atteint le segment inférieur du follicule pileux et peut s’étendre au tissu sous-cutané sous forme de furonculose. Cette infection sévère se caractérise cliniquement par des nodules érythémateux fermes, douloureux à la palpation, qui peuvent évoluer vers l’abcédation avec formation de trajets fistuleux drainant un exsudat hémorragique ou purulent. Les zones corporelles à follicules profonds comme la région du menton (folliculite mentonnière ou acné canine), les espaces interdigitaux et les points de pression sont préférentiellement affectées. L’examen histopathologique révèle une rupture de la paroi folliculaire avec libération du contenu folliculaire (bactéries, kératine, sébum) dans le derme environnant, déclenchant une réaction granulomateuse pyogranulomateuse intense centrée sur les débris kératiniques. La présence de macrophages épithélioïdes, de cellules géantes multinucléées et d’une fibrose progressive caractérise cette inflammation chronique.
Pododermatite et kystes interdigitaux
La pododermatite, inflammation des coussinets plantaires et des espaces interdigitaux, constitue une localisation particulièrement problématique chez le Bouledogue Français en raison de la conformation anatomique des membres et du poids corporel élevé sur une surface d’appui réduite. La pododermatite du Bouledogue Français présente souvent une étiologie multifactorielle combinant dermatite atopique, dermatite à Malassezia et pyodermite bactérienne secondaire. Les espaces interdigitaux deviennent érythémateux, œdématiés et douloureux, avec formation de bulles hémorragiques et de trajets fistuleux dans les cas sévères. Le léchage compulsif aggrave les lésions par traumatisme mécanique répété et inoculation salivaire continue. Les kystes interdigitaux, nodules fluctuants ou fermes des espaces interdigitaux, résultent d’une folliculite et furonculose profonde avec formation d’abcès enkystés. L’examen cytologique du contenu kystique révèle typiquement une inflammation pyogranulomateuse avec neutrophiles dégénérés, macrophages activés et matériel kératineux, avec ou sans bactéries visibles selon le stade évolutif.
Pyodermite mucocutanée : érosions et ulcérations
La pyodermite mucocutanée, affection dermatologique rare mais documentée chez le Berger Allemand et sporadiquement rapportée chez d’autres races dont le Bouledogue Français, se caractérise par une inflammation érosive et ulcérative des jonctions mucocutanées, particulièrement labiale, nasale, périanale et génitale. Cette dermatose présente une physiopathologie immunologique complexe impliquant une réaction d’hypersensibilité aux antigènes bactériens staphylococciques combinée à un déficit fonctionnel des lymphocytes T suppresseurs. Les lésions débutent par un érythème et un œdème de la jonction mucocutanée, évoluant rapidement vers des érosions puis ulcérations superficielles douloureuses avec formation de croûtes hémorragiques. L’examen histopathologique révèle une interface dermatite lichénoïde avec dégénérescence hydropique de la couche basale, infiltrat lymphoplasmocytaire périvasculaire et apoptose kératinocytaire. La culture bactérienne isole régulièrement Staphylococcus pseudintermedius, mais l’amélioration sous antibiothérapie reste partielle et transitoire, nécessitant fréquemment l’adjonction d’immunomodulateurs.
Module 6 : La démodécie
Démodécie juvénile
Une dermatose parasitaire qui n’a pas disparu
La démodécie canine résulte de la prolifération pathologique excessive d’acariens commensaux du genre Demodex, principalement Demodex canis et plus rarement Demodex injai, colonisant normalement les follicules pileux et les glandes sébacées de la peau canine à faibles densités. La transmission de Demodex canis survient verticalement de la chienne aux chiots nouveau-nés par contact direct durant les premiers jours de lactation, les acariens migrant des mamelles maternelles vers les follicules pileux de la face et des membres antérieurs des nouveau-nés. Chez la majorité des chiens, les populations d’acariens demeurent en équilibre homéostatique à des densités inférieures au seuil pathologique durant toute l’existence, maintenues sous contrôle par les défenses immunitaires innées et adaptatives locales. Dans une minorité d’individus, une rupture de cet équilibre permet la prolifération acarienne excessive générant des lésions cutanées inflammatoires. Cette rupture homéostatique survient soit par dysfonction immunitaire primaire génétiquement déterminée dans la démodécie juvénile, soit par immunosuppression secondaire acquise dans la démodécie de l’adulte.
L’analyse épidémiologique britannique VetCompass conduite sur 455 553 chiens en soins vétérinaires primaires durant l’année 2013 révèle une prévalence annuelle globale de 0,17% avec intervalle de confiance à 95% de 0,16 à 0,19% pour la démodécie dans la population canine générale. La distinction par âge démontre une prévalence dramatiquement supérieure chez les jeunes avec 0,48% et intervalle de confiance de 0,45 à 0,52% pour les chiens âgés de moins de 2 ans, comparativement à 0,05% et intervalle de confiance de 0,04 à 0,06% pour les chiens âgés de plus de 4 ans, ratio illustrant que la démodécie juvénile survient environ dix fois plus fréquemment que la forme adulte. Parmi les 702 cas pour lesquels l’âge au premier diagnostic était disponible, l’âge médian s’établissait à 7 mois avec intervalle interquartile de 4 à 13 mois, 72,4% des cas étaient âgés de moins de 1 an, 79,6% de moins de 1,5 an, 81,6% de moins de 2 ans et seulement 14,0% de plus de 4 ans. Cette distribution d’âge confirme la prédominance massive de la présentation juvénile de la démodécie canine dans la pratique vétérinaire primaire.
Le Bouledogue français manifeste une susceptibilité raciale significative à la démodécie juvénile avec un odds ratio ajusté de 5,07 et intervalle de confiance de 3,37 à 7,63 comparativement aux chiens croisés dans le modèle multivarié incluant race, poids relatif à la moyenne raciale, âge et statut sexe-stérilisation avec clinique vétérinaire comme effet aléatoire. Cette prédisposition place le Bouledogue français au sixième rang des races à risque élevé après le Bouledogue anglais avec odds ratio de 11,26, le Staffordshire Bull Terrier avec odds ratio de 7,11, le Shar-Pei chinois avec odds ratio de 6,57, le Dogue de Bordeaux avec odds ratio de 5,92 et le Carlin avec odds ratio de 5,41. La prévalence annuelle brute de démodécie chez le Bouledogue français âgé de moins de 2 ans atteint 1,88% avec intervalle de confiance de 1,30 à 2,73%, soit quatre fois la prévalence observée chez les chiens croisés de 0,37% et deux à trois fois supérieure à celle du Boxer. Remarquablement, aucun cas de démodécie n’a été identifié chez les Bouledogues français âgés de plus de 4 ans dans cette cohorte, suggérant soit que les individus présentant une susceptibilité génétique manifestent leur maladie précocement soit que les Bouledogues français affectés par démodécie juvénile sont majoritairement guéris et ne développent pas de forme récurrente à l’âge adulte.
L’appartenance commune du Bouledogue anglais, du Bouledogue français, du Staffordshire Bull Terrier, du Dogue de Bordeaux et du Boxer à la même clade génétique identifiée par analyses phylogénétiques pangénomiques suggère fortement une base génétique partagée pour la susceptibilité à la démodécie juvénile. Cette clade, regroupant les races de type bulldog et bull terrier, partage des variants génétiques ancestraux communs résultant de goulots d’étranglement populationnels historiques et de sélection intensive sur des caractéristiques morphologiques communes incluant brachycéphalie, corps trapu et tempérament. L’observation convergente d’études épidémiologiques indépendantes américaines et britanniques identifiant les mêmes races de cette clade génétique parmi les plus prédisposées renforce l’hypothèse d’un déterminisme génétique substantiel pour la démodécie juvénile. La nature précise des variants causaux, leur mode de transmission et leur pénétrance demeurent toutefois non élucidés. Le consensus actuel postule un mode d’hérédité polygénique complexe impliquant de multiples loci à effet modéré plutôt qu’une mutation monogénique Mendélienne, cohérent avec la variabilité phénotypique observée au sein des portées affectées.
Un dysfonctionnement immunitaire avant tout
La physiopathologie de la démodécie juvénile implique une dysfonction immunitaire spécifique aux acariens Demodex, les chiens affectés manifestant des réponses immunitaires normales vis-à-vis d’autres agents pathogènes. Les investigations immunologiques ont révélé des perturbations quantitatives et qualitatives des sous-populations lymphocytaires T chez les chiens démodéciques. Une étude fonctionnelle démontrait que les lymphocytes T de chiens démodéciques généralisés présentaient une prolifération blastique réduite en réponse à la stimulation par phytohémagglutinine et concanavaline A comparativement aux contrôles sains, suggérant un déficit de réactivité lymphocytaire T. Les ratios de sous-populations lymphocytaires CD4 positif et CD8 positif s’avéraient altérés avec une proportion réduite de lymphocytes T auxiliaires CD4 positif. La production de cytokines par les lymphocytes stimulés manifestait un déséquilibre vers une polarisation Th2 avec sécrétion accrue d’interleukine-4 et d’interleukine-10 immunosuppressives au détriment de l’interféron-gamma et de l’interleukine-2 pro-inflammatoires de type Th1, polarisation inadéquate pour le contrôle d’une infestation parasitaire intrafolliculaire nécessitant une réponse cellulaire cytotoxique robuste.
Une dermatsoe très pléomorphe
La présentation clinique de la démodécie canine se décline selon deux classifications complémentaires. La classification par âge distingue la forme juvénile débutant typiquement entre 3 et 18 mois de la forme adulte apparaissant après . La classification par étendue lésionnelle différencie la forme localisée, caractérisée par moins de cinq lésions focales de diamètre inférieur à 2,5 centimètres avec pronostic favorable de résolution spontanée dans 90% des cas sans traitement acaricide, de la forme généralisée définie par plus de cinq lésions, atteinte de plus de deux régions anatomiques, pododémodécie affectant au moins deux pattes, ou lésions extensives couvrant une surface corporelle totale supérieure à celle d’un membre. La démodécie généralisée nécessite invariablement un traitement acaricide systémique et comporte un pronostic réservé. Les lésions cutanées primaires consistent en alopécies non inflammatoires multifocales à coalesentes prédominant initialement en régions péri-oculaires, commissures labiales, face interne des pavillons auriculaires et membres, zones anatomiques où la colonisation acarienne initiale des chiots nouveau-nés est maximale.
Dans les formes compliquées, fréquentes chez le Bouledogue français en raison de la coexistence habituelle avec dermatite atopique et plis cutanés, l’infestation démodécique massive rompt la barrière cutanée folliculaire et favorise les infections bactériennes secondaires sévères. La folliculite puis furonculose bactériennes à Staphylococcus pseudintermedius génèrent pustules, papules érythémateuses, croûtes, exsudation séro-purulente et douleur locale intense. Les formes profondes évoluent vers cellulite dermique et hypodermique avec œdème massif, fistulisation, drainage purulent et adénomégalie satellite. Les pododermatites démodéciques interdigitées, particulièrement fréquentes et réfractaires, associent érythème violacé, tuméfaction des espaces interdigités, fistules drainantes, hyperkératose palmoplantaire et boiterie d’appui par douleur. La chronicité induit hyperpigmentation, lichenification, fibrose dermique et alopécie cicatricielle irréversible dans les cas négligés.
Un diagnostic rapdie et simple
Le diagnostic de démodécie repose sur l’identification microscopique d’acariens Demodex en nombre anormal dans les raclages cutanés profonds. La technique standardisée requiert compression vigoureuse d’un pli cutané entre le pouce et l’index durant 10 à 15 secondes pour expulser les acariens du fond des follicules pileux, suivie immédiatement du raclage perpendiculaire au sens du poil avec une lame de scalpel préalablement enduite d’huile minérale, poursuivi jusqu’à suintement capillaire, garant d’une profondeur de prélèvement suffisante atteignant la jonction dermo-épidermique. Le matériel raclé est transféré sur lame, recouvert d’une lamelle et examiné au microscope à grossissements 40 fois et 100 fois pour dénombrer acariens adultes fusiformes, nymphes, larves hexapodes et œufs operculés caractéristiques. Un minimum de cinq raclages issus de sites lésionnels distincts devrait être réalisé pour maximiser la sensibilité diagnostique. Le trichogramme, consistant en l’arrachement de multiples poils à la pince suivi de leur examen microscopique après montage entre lame et lamelle dans de l’huile, constitue une alternative moins invasive particulièrement utile pour les localisations périoculaires et interdigitées difficiles à racler.
La révolution des isoxazolines
Les protocoles thérapeutiques de la démodécie canine ont été révolutionnés par l’avènement des isoxazolines orales, classe pharmacologique d’ectoparasiticides modulant les canaux chlorure dépendants du GABA et du glutamate des invertébrés, induisant paralysie et mort des arthropodes parasites.
La démodécie de l’adulte, rare mais à ne pas négliger
La prise en charge de la démodécie adulte nécessite impérativement l’identification et le traitement des causes sous-jacentes d’immunosuppression. Les affections endocriniennes incluant hypothyroïdie, hypercorticisme spontané ou iatrogénique, et diabète sucré devraient être systématiquement dépistées par dosages hormonaux appropriés. Les néoplasies, particulièrement lymphome et mastocytome, et les maladies auto-immunes systémiques constituent d’autres causes d’immunosuppression favorisant la démodécie adulte. Les traitements immunosuppresseurs incluant glucocorticoïdes systémiques, ciclosporine et agents chimiothérapeutiques doivent être interrompus si possible.
Module 7 : Approche diagnostique multimodale
Méthodologie clinique et système DAMN-IT
Le diagnostic dermatologique chez le Bouledogue Français nécessite une approche méthodique intégrant l’anamnèse détaillée, l’examen clinique rigoureux et les examens complémentaires ciblés. La complexité du tableau dermatologique de cette race, combinant fréquemment plusieurs pathologies superposées (atopie primaire, dermatite à Malassezia, pyodermite secondaire, intertrigo), exige du praticien une capacité d’analyse séquentielle pour identifier l’affection primaire initiale et ses complications secondaires. L’approche diagnostique structurée selon la méthode DAMN-IT (Developmental, Allergic, Metabolic, Neoplastic, Inflammatory, Traumatic, Infectious, Immunologic) permet d’élaborer une liste différentielle exhaustive avant de la restreindre progressivement par élimination ou confirmation diagnostique.
L’anamnèse : pilier du raisonnement diagnostique
L’anamnèse constitue la pierre angulaire du raisonnement diagnostique en dermatologie. L’interrogatoire minutieux du propriétaire doit documenter plusieurs paramètres temporels et contextuels essentiels. L’âge d’apparition des premiers signes cliniques oriente significativement le diagnostic différentiel: un début précoce avant 6 mois suggère une dermatose congénitale ou héréditaire, tandis qu’un début entre 6 mois et 3 ans évoque fortement une dermatite atopique. La saisonnalité des symptômes différencie une atopie saisonnière liée aux pollens d’une atopie perannuelle induite par les acariens de poussière ou les allergènes alimentaires. Le caractère prurigineux de l’affection, évalué par questionnaire standardisé ou échelle visuelle analogique, représente un critère diagnostique majeur: un prurit sine materia (prurit sans lésion primaire visible) oriente vers une hypersensibilité allergique, tandis qu’as des lésions primaires sans prurit suggèrent une dermatose métabolique ou néoplasique. L’environnement de vie (urbain/rural), le mode de logement (intérieur/extérieur), l’exposition à d’autres animaux et les antécédents de voyages documentent le risque d’exposition à des ectoparasites ou agents infectieux.
Examen clinique systématique et otoscopie
L’examen clinique dermatologique du Bouledogue Français suit une méthodologie systématique débutant par l’observation à distance de l’état général, du comportement et des signes de prurit (léchage, mordillement, frottement). L’examen rapproché évalue la distribution des lésions selon un schéma anatomique standardisé, distinguant les lésions primaires (macules, papules, pustules, vésicules, nodules) des lésions secondaires (érosions, ulcères, croûtes, squames, hyperpigmentation, lichénification). La palpation apprécie l’épaississement cutané, l’œdème sous-cutané et la sensibilité douloureuse des zones affectées. L’examen des muqueuses apparentes (conjonctivale, buccale, génitale) recherche une extension des lésions aux jonctions mucocutanées. L’inspection otoscopique bilatérale évalue l’état du conduit auditif externe et de la membrane tympanique, l’otite externe étant présente chez 75 à 80% des Bouledogues Français atopiques. La palpation des nœuds lymphatiques régionaux (sous-mandibulaires, pré-scapulaires, poplités) détecte une lymphadénomégalie réactionnelle traduisant une inflammation ou infection cutanée du territoire drainé.
Cytologie cutanée : identification cellulaire et microbienne
L’examen cytologique cutané représente l’examen complémentaire de première intention en dermatologie vétérinaire, praticable en consultation sans équipement sophistiqué. Plusieurs techniques de prélèvement s’appliquent selon le type de lésion. La technique d’apposition directe sur lame de verre s’utilise pour les surfaces érythémateuses ou exsudatives. Le scotch-test, particulièrement adapté aux espaces interdigitaux et plis, consiste à appliquer un morceau de ruban adhésif transparent sur la zone à examiner puis à le coller sur une lame. L’écouvillonnage suivi d’un roulement sur lame permet d’explorer les conduits auriculaires ou les lésions profondes. La ponction à l’aiguille fine (cytoponction) des nodules ou kystes prélève le contenu cellulaire pour analyse. Après séchage à l’air, les lames subissent une coloration rapide type Diff-Quik (équivalent du May-Grünwald-Giemsa) permettant la différenciation cellulaire. L’examen microscopique au grossissement 400 puis 1000 sous immersion caractérise la population cellulaire inflammatoire (neutrophiles, éosinophiles, macrophages, lymphocytes), identifie les micro-organismes (cocci ou bacilles bactériens, levures Malassezia, dermatophytes rares) et détecte les cellules atypiques suggérant une néoplasie.
Raclage cutané et diagnostic parasitaire
Le raclage cutané, examen parasitologique essentiel, recherche les acariens responsables de gales. Deux types de raclages s’effectuent selon la profondeur recherchée. Le raclage superficiel, réalisé jusqu’à l’apparition d’un érythème léger, détecte Sarcoptes scabiei, acarien responsable de la gale sarcoptique caractérisée par un prurit intense récalcitrant. Le raclage profond, poursuivi jusqu’au suintement capillaire, met en évidence Demodex canis, acarien folliculaire commensal pouvant proliférer lors de démodécie. Bien que le Bouledogue Français ne figure pas parmi les races à risque élevé de démodécie généralisée (contrairement au Shar-Pei ou au Bull Terrier), des cas de démodécie localisée périoculaire ou des lèvres surviennent occasionnellement. Le matériel de raclage, transféré sur lame avec une goutte d’huile minérale ou de lactophénol, est examiné au microscope au grossissement 100 puis 400. L’identification d’adultes, larves, nymphes ou œufs d’acariens confirme le diagnostic parasitaire.
Trichoscopie : analyse de la tige pilaire et du cycle
La trichoscopie ou examen microscopique du poil complète l’arsenal diagnostique pour les alopécies. Un prélèvement de poils par arrachement doux à la pince hémostatique dans les zones alopéciques permet l’analyse de la tige pilaire et du bulbe. L’examen au microscope à faible puis fort grossissement évalue la phase du cycle pilaire (anagène avec bulbe pigmenté et gaine épithéliale, télogène avec bulbe en massue sans gaine), recherche des anomalies structurelles de la tige (trichorrhexis nodosa, trichomalacia) et identifie des spores fongiques en cas de dermatophytose. Chez le Bouledogue Français, l’alopécie résulte le plus souvent du prurit avec arrachement mécanique des poils (alopécie traumatique), et la trichoscopie révèle alors des tiges pilaires fracturées aux extrémités irrégulières sans anomalie du bulbe, contrastant avec les alopécies endocriniennes où les poils s’épilent facilement avec des bulbes en télogène.
Tests allergologiques : IDT et dosages sériques d’IgE
Les tests allergologiques s’indiquent chez le Bouledogue Français après confirmation du diagnostic de dermatite atopique selon les critères de Favrot, afin d’identifier les allergènes impliqués et d’envisager une immunothérapie spécifique. Deux approches complémentaires coexistent: les tests intradermiques (IDT) et les dosages sériques d’IgE spécifiques. Le test intradermique représente le gold standard, injectant en intradermique au niveau du thorax tondu une batterie d’allergènes standardisés (acariens, pollens, moisissures, épithéliaux) dilués dans une solution saline. La lecture après 15 à 20 minutes quantifie la réaction papuleuse et érythémateuse comparativement aux témoins positif (histamine) et négatif (soluté physiologique). Un résultat positif se définit par une papule de diamètre supérieur à 50% de la réaction histaminique. Les dosages sérologiques d’IgE allergènes-spécifiques par technique ELISA ou immunoblot constituent une alternative moins invasive, bien que leur sensibilité et spécificité restent inférieures aux IDT. Une concordance imparfaite existe entre ces deux méthodes, avec un accord dans seulement 60 à 70% des cas, justifiant l’interprétation clinique des résultats plutôt que leur application mécanique.
Régime d’éviction et épreuve de provocation alimentaire
Le régime d’éviction alimentaire représente le seul test diagnostique fiable pour confirmer ou exclure une hypersensibilité alimentaire contributive au tableau clinique. Ce régime consiste à alimenter exclusivement le chien pendant 8 à 12 semaines avec une source de protéines et de glucides auxquelles l’animal n’a jamais été exposé (régime à protéine nouvelle) ou avec un aliment hydrolysé dont les protéines fragmentées en peptides de faible poids moléculaire (< 10 kDa) perdent leur allergénicité. L’observance stricte constitue le facteur limitant majeur de ce test, toute infraction alimentaire (friandises, restes de table, médicaments aromatisés) invalidant le résultat. Une amélioration clinique supérieure à 50% du prurit et des lésions cutanées sous régime évoque fortement une composante alimentaire. La confirmation diagnostique nécessite une épreuve de provocation par réintroduction de l’alimentation antérieure, devant déclencher une rechute dans les 7 à 14 jours. Si la rechute survient, la réintroduction progressive d’ingrédients individuels permet d’identifier le ou les allergènes spécifiques responsables.
Examen histopathologique et biopsies cutanées
L’examen histopathologique cutané, bien que non spécifique pour la dermatite atopique, s’indique lors de présentation clinique atypique, de réponse thérapeutique inadéquate ou de suspicion de processus néoplasique ou auto-immun. Les biopsies cutanées au punch de 6 à 8 millimètres s’effectuent sous anesthésie locale ou générale, prélevant des lésions primaires représentatives en évitant les zones de chronicité extrême ou surinfectées. Le prélèvement de lésions à différents stades évolutifs et l’inclusion d’un échantillon de peau périphérique saine optimisent l’information diagnostique. Les échantillons fixés en formol tamponné à 10% subissent un traitement histotechnique standard avec inclusion en paraffine, coupe et coloration hématoxyline-éosine. L’analyse microscopique par un dermatopathologiste vétérinaire caractérise l’architecture lésionnelle, le type et la distribution de l’infiltrat inflammatoire, et recherche des indices étiologiques. La dermatite atopique présente typiquement une dermatite périvasculaire superficielle avec infiltrat lympho-histiocytaire et éosinophilique, une hyperplasie épidermique (acanthose), une hyperkératose orthokératosique et une spongiose variable selon l’acuité lésionnelle.
Module 8 : Stratégies thérapeutiques intégrées et perspectives
Objectifs d’une prise en charge multimodale
La prise en charge thérapeutique de la dermatite atopique et des complications dermatologiques associées chez le Bouledogue Français nécessite une approche multimodale et individualisée combinant contrôle des infections secondaires, traitement anti-inflammatoire et anti-prurigineux, restauration de la barrière cutanée, et gestion des facteurs environnementaux. L’objectif thérapeutique réaliste vise non pas la guérison définitive de cette dermatose chronique, mais le contrôle satisfaisant des symptômes permettant une qualité de vie acceptable pour l’animal et son propriétaire, avec minimisation des effets secondaires et du coût économique sur le long terme. La stratégie thérapeutique évolue selon la sévérité initiale, la réponse aux traitements et la présence de comorbidités, nécessitant des réévaluations régulières et des ajustements posologiques ou molécules.
Traitement des infections secondaires et antibiothérapie
Le traitement des infections secondaires constitue impérativement la première étape thérapeutique avant d’évaluer la réponse aux anti-inflammatoires. Les pyodermites superficielles à Staphylococcus pseudintermedius sensible à la méticilline répondent généralement à une antibiothérapie systémique par céphalosporines de première génération (céphalexine 15 à 25 mg/kg per os deux fois par jour) ou par amoxicilline-acide clavulanique (12,5 à 25 mg/kg per os deux fois par jour) pendant 21 à 28 jours minimum, soit une semaine au-delà de la résolution clinique complète. Les pyodermites profondes ou les souches MRSP nécessitent des antibiothérapies prolongées de 6 à 8 semaines avec des molécules à spectre élargi: fluoroquinolones (enrofloxacine 5 à 10 mg/kg une fois par jour, marbofloxacine 2,75 à 5,5 mg/kg une fois par jour) après réalisation d’une culture bactérienne avec antibiogramme. La résistance croissante impose une utilisation raisonnée des antibiotiques selon les recommandations d’antibiothérapie prudente, privilégiant les traitements topiques lorsque possible.
Usage des antiseptiques topiques et chlorhexidine
Les antiseptiques topiques représentent une alternative ou un complément précieux à l’antibiothérapie systémique, particulièrement pour les infections localisées ou récurrentes. La chlorhexidine, biguanide cationique à large spectre bactéricide et fongicide, s’utilise en shampooing à concentration de 2 à 4% avec un temps de contact de 10 minutes avant rinçage, à raison de deux à trois applications hebdomadaires. Son mécanisme d’action repose sur la désorganisation membranaire bactérienne par liaison aux phospholipides anioniques. Les études cliniques contrôlées démontrent une efficacité de la chlorhexidine 3% comparable aux antibiotiques systémiques pour les pyodermites superficielles localisées, avec l’avantage d’éviter la sélection de résistances systémiques. Les formulations combinant chlorhexidine et miconazole (antifongique azolé) traitent simultanément les infections bactériennes et à Malassezia, fréquemment intriquées chez le Bouledogue Français. Les lingettes imprégnées de chlorhexidine facilitent l’antisepsie quotidienne des plis faciaux, prévenant l’intertrigo.
Inhibiteurs de Janus kinases
Les inhibiteurs de Janus kinases (JAK inhibitors) représentent une avancée thérapeutique majeure en dermatologie vétérinaire depuis l’autorisation de mise sur le marché de l’oclacitinib en 2013 pour le traitement symptomatique du prurit atopique canin. L’oclacitinib, petite molécule de synthèse administrée par voie orale, inhibe sélectivement les tyrosines kinases JAK1 et JAK3 (et dans une moindre mesure JAK2), bloquant ainsi la transduction du signal de multiples cytokines pro-prurigineuses et pro-inflammatoires dont l’IL-31, l’IL-4, l’IL-13 et l’IL-2. Récemment de nouveaux inihibiteurs des janus kinase ont été commercialisés, à savoir l’ilunocitinib (Zenrelia) et l’atinvicitinib (Numelvi), chacun présentant divers avantages et inconvénients.
Lokivetmab : anticorps monoclonal anti-IL-31
Le lokivetmab, anticorps monoclonal canin caninisé dirigé spécifiquement contre l’interleukine-31, constitue une alternative biothérapeutique à l’oclacitinib. Cet anticorps thérapeutique, produit par technologie recombinante, neutralise l’IL-31 circulante par liaison à haute affinité, empêchant son interaction avec le complexe récepteur IL-31RA/OSMR. L’administration se fait par voie sous-cutanée à la posologie de 1 à 2 mg/kg, avec une durée d’action prolongée de 4 à 8 semaines permettant des injections mensuelles. Les études pivots de phase III révèlent une réduction du prurit de plus de 50% chez 79% des chiens traités après la première injection, avec un délai d’action médian de 1,2 jours. L’avantage majeur du lokivetmab réside dans sa spécificité immunologique extrême, ciblant uniquement l’IL-31 sans interférer avec d’autres voies de signalisation, minimisant ainsi les effets secondaires systémiques. Sa nature protéique d’immunoglobuline canine limite le risque d’immunogénicité avec formation d’anticorps anti-médicament, contrairement aux protéines recombinantes non caninisées.
Cyclosporine et inhibition de la calcineurine
La cyclosporine, immunomodulateur inhibiteur de la calcineurine, représente historiquement le premier traitement systémique validé pour la dermatite atopique canine avec autorisation de mise sur le marché depuis 2003. Cette molécule lipophile cyclique dérivée du champignon Tolypocladium inflatum inhibe l’activation des lymphocytes T par blocage de la phosphatase calcineurine, empêchant la déphosphorylation du facteur de transcription NFAT (Nuclear Factor of Activated T-cells) et sa translocation nucléaire. La cascade transcriptionnelle des cytokines pro-inflammatoires IL-2, IL-4, IL-5, IL-13 et TNF-α se trouve ainsi bloquée. La posologie initiale de 5 mg/kg par voie orale une fois par jour, administrée à jeun pour optimiser l’absorption, se poursuit pendant 4 à 6 semaines jusqu’à obtention d’une réponse clinique satisfaisante, puis se réduit progressivement à la dose minimale efficace, souvent 2,5 à 5 mg/kg tous les 2 à 3 jours en entretien. Les effets secondaires gastro-intestinaux (vomissements, diarrhée, anorexie) surviennent chez 20 à 30% des chiens, principalement durant les premières semaines, et s’atténuent généralement spontanément ou par administration avec un repas léger malgré la réduction d’absorption.
Place des glucocorticoïdes dans les poussées aiguës
Les glucocorticoïdes systémiques, anti-inflammatoires puissants à action rapide, conservent une place dans le traitement d’urgence des poussées aiguës sévères malgré leurs effets secondaires à long terme. La prednisolone ou prednisone s’administre à dose anti-inflammatoire de 0,5 à 1 mg/kg par voie orale une à deux fois par jour jusqu’au contrôle du prurit et de l’inflammation (généralement 7 à 14 jours), suivie d’une décroissance progressive sur 2 à 3 semaines puis sevrage complet ou transition vers un traitement alternatif. L’utilisation chronique quotidienne de corticoïdes entraîne inévitablement un syndrome de Cushing iatrogène avec polyuro-polydipsie, polyphagie, amyotrophie, hépatomégalie et immunosuppression favorisant les infections opportunistes. Un schéma alterné avec administration un jour sur deux limite partiellement la suppression de l’axe hypothalamo-hypophyso-surrénalien. Les corticoïdes injectables à action prolongée (méthylprednisolone acétate) sont formellement déconseillés en dermatologie en raison de l’impossibilité d’ajustement posologique et du risque accru d’effets secondaires sévères.
Rôle des émollients et topiques restructurants
Les topiques émollients et restructurants de la barrière jouent un rôle thérapeutique adjuvant essentiel souvent sous-estimé. Les formulations enrichies en céramides physiologiques, cholestérol et acides gras essentiels dans un ratio équimolaire mimant la composition lipidique du stratum corneum restaurent partiellement la fonction barrière déficiente. Une étude clinique prospective randomisée contrôlée évaluant un spray restructurant contenant un complexe de céramides, acides gras et phytosphingosine chez 60 chiens atopiques démontre une réduction significative du score CADESI de 42% après 8 semaines d’application biquotidienne, associée à une diminution de la perte insensible en eau trans-épidermique de 38%. Les shampooings thérapeutiques à base d’avoine colloïdale, d’acides gras oméga-6 et de glycérine exercent un effet antiprurigineux et hydratant immédiat, avec un bénéfice optimal lors d’utilisation bihebdomadaire avec temps de contact de 10 minutes. Les formulations sans savon (syndets ou synthetic detergents) au pH physiologique acide préservent le film lipidique cutané contrairement aux shampooings alcalins conventionnels.
Immunothérapie spécifique allergénique (désensibilisation)
L’immunothérapie allergénique spécifique (désensibilisation ou hyposensibilisation) représente le seul traitement potentiellement modificateur de la maladie atopique, visant à induire une tolérance immunologique aux allergènes identifiés plutôt qu’à simplement supprimer les symptômes. Le protocole classique par voie sous-cutanée débute par une phase d’induction avec injections hebdomadaires d’extraits allergéniques à concentrations croissantes sur 16 à 20 semaines, suivie d’une phase d’entretien avec injections mensuelles poursuivies pendant minimum 12 mois, idéalement 2 à 3 ans. Les mécanismes immunologiques impliqués incluent la déviation de la réponse Th2 vers Th1, l’induction de lymphocytes T régulateurs produisant l’IL-10 et le TGF-β immunosuppresseurs, et le switch isotypique de la production d’IgE vers IgG4 bloquantes. Les taux de succès rapportés dans la littérature vétérinaire varient considérablement selon les études, avec une amélioration excellente à bonne chez 60 à 75% des chiens, une amélioration modérée chez 15 à 20%, et un échec chez 10 à 15%. La réponse optimale nécessite souvent 9 à 12 mois de traitement avant évaluation définitive. Les protocoles intradermiques régionaux et les formulations sublinguales émergent comme alternatives potentiellement plus sûres et mieux tolérées.
Impact des acides gras polyinsaturés (Oméga-3 et 6)
Les acides gras polyinsaturés oméga-3 et oméga-6 à longues chaînes exercent des effets anti-inflammatoires et restructurants de la barrière par plusieurs mécanismes. L’acide eicosapentaénoïque (EPA, C20:5 ω-3) et l’acide docosahexaénoïque (DHA, C22:6 ω-3) contenus dans les huiles de poissons s’incorporent dans les phospholipides membranaires des cellules inflammatoires, se substituant partiellement à l’acide arachidonique (C20:4 ω-6). Lors d’activation cellulaire, la phospholipase A2 libère ces acides gras qui sont métabolisés par les cyclooxygénases et lipoxygénases en médiateurs de série 3 et 5 (prostaglandines PGE3, leucotriènes LTB5) moins pro-inflammatoires que leurs homologues de série 2 et 4 dérivés de l’acide arachidonique. La supplémentation à dose élevée (75 à 150 mg/kg d’EPA+DHA par jour) pendant minimum 8 à 12 semaines exerce un effet modéré sur le prurit atopique, avec une réduction moyenne de 20 à 30% dans les études contrôlées, justifiant leur utilisation comme adjuvant thérapeutique mais non en monothérapie.
Perspectives thérapeutiques futures et thérapie génique
Les perspectives thérapeutiques futures en dermatologie atopique canine s’orientent vers des cibles moléculaires de plus en plus spécifiques. Le dupilumab, anticorps monoclonal humain ciblant la sous-unité alpha du récepteur de l’IL-4 et bloquant ainsi la signalisation de l’IL-4 et de l’IL-13, révolutionne actuellement le traitement de la dermatite atopique humaine sévère avec des taux de réponse supérieurs à 70%. Le développement d’un équivalent canin caninisé représente une piste prometteuse. Les inhibiteurs topiques de JAK (ruxolitinib, tofacitinib en formulations dermiques) permettraient un blocage ciblé de la signalisation pro-inflammatoire cutanée sans immunosuppression systémique. Les probiotiques et prébiotiques visant à moduler le microbiome cutané et intestinal font l’objet de recherches intensives, certaines souches de Lactobacillus démontrant in vitro des propriétés immunomodulatrices avec induction de lymphocytes T régulateurs. La thérapie génique par transfert du gène FLG fonctionnel dans les kératinocytes reste du domaine expérimental mais pourrait théoriquement corriger le déficit primaire de filaggrine. Les vaccins thérapeutiques à base de peptides immunomodulateurs dérivent de l’allergène mais dépourvus d’épitopes IgE-réactifs pourraient induire une tolérance sans risque anaphylactique.
Conclusion
Le Bouledogue Français présente une vulnérabilité dermatologique exceptionnelle résultant d’une convergence unique de facteurs anatomiques, génétiques et immunologiques. La conformation brachycéphale extrême engendre des plicatures cutanées pathologiques prédisposant à l’intertrigo et aux surinfections microbiennes. Les anomalies génétiques documentées affectant le gène PROM1 et l’expression des protéines de la barrière épidermique compromettent la cohésion du stratum corneum et augmentent la perméabilité transcutanée aux allergènes. La dysfonction primaire de la barrière se caractérise par une déficience en filaggrine, une déplétion céramidique et une altération des jonctions serrées, créant le substrat physiopathologique de la dermatite atopique dont la prévalence atteint 15 à 20% dans cette population raciale.
La pathogenèse immunologique complexe implique une polarisation Th2 excessive avec hyperproduction d’IL-4, IL-13, IL-5 et IL-31, conduisant à une synthèse massive d’IgE spécifiques et à un recrutement éosinophilique tissulaire. La dysbiose cutanée avec expansion de Staphylococcus pseudintermedius et Malassezia pachydermatis amplifie l’inflammation par production d’exotoxines superantigéniques et d’enzymes protéolytiques. Les complications infectieuses secondaires, notamment les pyodermites récurrentes et les dermatites à Malassezia, constituent la règle plutôt que l’exception, nécessitant une prise en charge antimicrobienne rigoureuse préalable à toute évaluation de la réponse anti-inflammatoire.
L’approche diagnostique repose sur une méthodologie clinique structurée intégrant anamnèse détaillée, examen dermatologique systématique et examens complémentaires ciblés, particulièrement la cytologie cutanée praticable en première intention. L’identification des infections secondaires et leur traitement approprié constituent impérativement la première étape thérapeutique. La stratégie de contrôle à long terme combine traitement symptomatique du prurit par inhibiteurs de JAK ou anticorps anti-IL-31, restauration de la barrière épidermique par topiques restructurants, et gestion des facteurs environnementaux déclenchants.
Les perspectives de recherche futures devront approfondir la caractérisation du déterminisme génétique racial par études d’association pangénomique, identifier les variants spécifiques des gènes de la barrière épidermique prédisposant à l’atopie chez le Bouledogue Français, et développer des thérapies ciblées correctrices de ces déficits moléculaires primaires. L’exploration du microbiome cutané par séquençage métagénomique et l’identification de signatures dysbiotiques prédictives de l’évolution clinique pourraient permettre des interventions précoces par probiotiques ou transplantation microbienne. Le développement de biothérapies canines ciblant les cytokines Th2 clés, notamment des anticorps monoclonaux anti-IL-4Rα ou anti-IL-13, ouvre des perspectives thérapeutiques révolutionnaires. Enfin, les stratégies préventives précoces visant à restaurer la barrière épidermique dès les premiers mois de vie chez les chiots à risque méritent une investigation approfondie pour déterminer si une intervention néonatale pourrait prévenir ou retarder l’installation de la dermatite atopique cliniquement manifeste.
Références
Outerbridge CA, Jordan TJM. Current Knowledge on Canine Atopic Dermatitis: Pathogenesis and Treatment. Advances in Small Animal Care. 2021;2(1):101-117. PMC9204668.
Bajwa J. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. Canadian Veterinary Journal. 2015;56(8):758-765. PMC4531508.
Zur G, Ihrke PJ, White SD, Kass PH. Canine atopic dermatitis: a retrospective study of 266 cases examined at the University of California, Davis, 1992-1998. Part I. Clinical features and allergy testing results. Veterinary Dermatology. 2002;13(2):89-102.
Marsella R, Olivry T, Nicklin C, Lopez J. Pilot investigation of a model for canine atopic dermatitis: environmental house dust mite challenge of high-IgE-producing beagles, mite hypersensitive dogs with atopic dermatitis and normal dogs. Veterinary Dermatology. 2006;17(1):24-35.
Olivry T, DeBoer DJ, Favrot C, et al. Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). BMC Veterinary Research. 2015;11:210. PMC4531508.
Chermprapai S, Broere F, Gooris G, Schlotter YM, Rutten VPMG, Bouwstra JA. Altered lipid properties of the stratum corneum in Canine Atopic Dermatitis. Biochim Biophys Acta Biomembr. 2018;1860(2):526-533.
Pucheu-Haston CM, Bizikova P, Eisenschenk MN, Santoro D, Nuttall T, Marsella R. Review: The role of antibodies, autoantigens and food allergens in canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):115-e30.
Santoro D, Marsella R, Pucheu-Haston CM, et al. Review: Pathogenesis of canine atopic dermatitis: skin barrier and host-micro-organism interaction. Veterinary Dermatology. 2015;26(2):84-e25.
Banovic F, Linder KE, Olivry T. Clinical, microscopic and microbial characterization of exfoliative superficial pyoderma-associated epidermal collarettes in dogs. Veterinary Dermatology. 2017;28(1):107-e23.
Hensel P, Santoro D, Favrot C, Hill P, Griffin C. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Veterinary Research. 2015;11:196. PMC4531508.
Cosgrove SB, Wren JA, Cleaver DM, et al. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2013;24(6):587-597.
Gonzales AJ, Humphrey WR, Messamore JE, et al. Interleukin-31: its role in canine pruritus and naturally occurring canine atopic dermatitis. Veterinary Dermatology. 2013;24(1):48-e12.
Michels GM, Ramsey DS, Walsh KF, et al. A blinded, controlled study to investigate the efficacy and safety of a canine anti-IL-31 monoclonal antibody in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2016;27(6):505-e136.
Olivry T, Bizikova P. A systematic review of randomized controlled trials for prevention or treatment of atopic dermatitis in dogs: 2008-2011 update. Veterinary Dermatology. 2013;24(1):97-e26.
Marsella R, Girolomoni G. Canine models of atopic dermatitis: a useful tool with untapped potential. Journal of Investigative Dermatology. 2009;129(10):2351-2357.
Banovic F, Olivry T, Bazzle L, Tobias JR, Atlee B, Linder KE. Deep pyoderma caused by Pseudomonas aeruginosa in dogs: 20 cases. Veterinary Dermatology. 2016;27(6):494-e131.
Little PR, King VL, Davis KR, et al. A blinded, controlled multicenter study to assess the effectiveness and rate of flea kill of orally administered afoxolaner compared with topically applied fipronil/(S)-methoprene in dogs with flea allergy dermatitis. Veterinary Parasitology. 2015;207(3-4):306-312.
Loeffler A, Cobb MA, Bond R. Comparison of a chlorhexidine and a benzoyl peroxide shampoo as sole treatment in canine superficial pyoderma. Veterinary Record. 2011;169(10):249.
Mueller RS, Bergvall K, Bensignor E, Bond R. A review of topical therapy for skin infections with bacteria and yeast. Veterinary Dermatology. 2012;23(4):330-e62.
Noli C, Borio S, Varina A, Schievano C. Development and validation of a questionnaire to evaluate the Quality of Life of cats with skin disease and their owners, and its use in 185 cats with skin disease. Veterinary Dermatology. 2016;27(4):247-e58.
Nuttall TJ, Marsella R, Rosenbaum MR, Gonzales AJ, Fadok VA. Update on pathogenesis, diagnosis, and treatment of atopic dermatitis in dogs. Journal of the American Veterinary Medical Association. 2019;254(11):1291-1300.
Olivry T, Mueller RS, International Task Force on Canine Atopic Dermatitis. Evidence-based veterinary dermatology: a systematic review of the pharmacotherapy of canine atopic dermatitis. Veterinary Dermatology. 2003;14(3):121-146.
Piekutowska A, Pin D, Reme CA, Gatto H, Haftek M. Effects of a topically applied preparation of epidermal lipids on the stratum corneum barrier of atopic dogs. Journal of Comparative Pathology. 2008;138(4):197-203.
Reedy LM, Miller WH, Willemse T. Allergic Skin Diseases of Dogs and Cats. 2nd ed. London: WB Saunders; 1997.
Saridomichelakis MN, Koutinas AF, Farmaki R, Leontides LS, Kasabalis D. Relative sensitivity of hair pluckings and exudate microscopy for the diagnosis of canine demodicosis. Veterinary Dermatology. 2007;18(2):138-141.
Shimada K, Yoon JS, Yoshihara T, Iwasaki T, Nishifuji K. Increased transepidermal water loss and decreased ceramide content in lesional and non-lesional skin of dogs with atopic dermatitis. Veterinary Dermatology. 2009;20(5-6):541-546.
Shumaker AK, Angus JC, Coyner KS, Loeffler DG, Van Den Broek AHM, Sánchez A. Microbiological and histopathological features of canine pyotraumatic dermatitis (“hot spots”). Veterinary Dermatology. 2008;19(3):131-139.
Steffan J, Alexander D, Brovedani F, Fisch RD. Comparison of cyclosporine A with methylprednisolone for treatment of canine atopic dermatitis: a parallel, blinded, randomized controlled trial. Veterinary Dermatology. 2003;14(1):11-22.
Steffan J, Favrot C, Mueller R. A systematic review and meta-analysis of the efficacy and safety of cyclosporin for the treatment of atopic dermatitis in dogs. Veterinary Dermatology. 2006;17(1):3-16.
Thyssen JP, Godoy-Gijon E, Elias PM. Ichthyosis vulgaris: the filaggrin mutation disease. British Journal of Dermatology. 2013;168(6):1155-1166.
Wilhem S, Kovalik M, Favrot C. Breed-associated phenotypes in canine atopic dermatitis. Veterinary Dermatology. 2011;22(2):143-149.
Bizikova P, Papiernik D, Mendoza ME, Haile B, Olivry T. Studies Using Antibodies against Filaggrin and Filaggrin 2 in Canine Normal and Atopic Skin Biopsies. Veterinary Sciences. 2024;11(2):53. PMC10854974.
Zur G, White SD, Ihrke PJ, Kass PH, Toebe N. Canine atopic dermatitis: a retrospective study of 169 cases examined at the University of California, Davis, 1992-1998. Part II. Response to hyposensitization. Veterinary Dermatology. 2002;13(2):103-111.
Marsella R, Samuelson D, Doerr K. Transmission electron microscopy studies in an experimental model of canine atopic dermatitis. Veterinary Dermatology. 2010;21(1):81-88.
Marsella R, Olivry T, Carlotti DN. Current evidence of skin barrier dysfunction in human and canine atopic dermatitis. Veterinary Dermatology. 2011;22(3):239-248.
Nuttall T, Knight PA, McAleese SM, Lamb JR, Hill PB. Expression of Th1, Th2 and immunosuppressive cytokine gene transcripts in canine atopic dermatitis. Clinical & Experimental Allergy. 2002;32(5):789-795.
Bruet V, Bourdeau PJ, Roussel A, Imparato L, Desfontis JC. Characterization of pruritus in canine atopic dermatitis, flea bite hypersensitivity and flea infestation and its role in diagnosis. Veterinary Dermatology. 2012;23(6):487-e93.
Olivry T, Dunston SM, Murphy KM, Moore PF. Characterization of the inflammatory infiltrate during IgE-mediated late phase reactions in the skin of normal and atopic dogs. Veterinary Dermatology. 2001;12(1):49-58.
Sousa CA, Marsella R. The ACVD task force on canine atopic dermatitis (II): genetic factors. Veterinary Immunology and Immunopathology. 2001;81(3-4):153-157.
DeBoer DJ, Marsella R. The ACVD task force on canine atopic dermatitis (XII): the relationship of cutaneous infections to the pathogenesis and clinical course of canine atopic dermatitis. Veterinary Immunology and Immunopathology. 2001;81(3-4):239-249.
Older CE, Diesel A, Patterson AP, Meason-Smith C, Johnson TJ, Rodrigues Hoffmann A. The feline skin microbiota: The bacteria inhabiting the skin of healthy and allergic cats. PLoS One. 2017;12(6):e0178555.
Bradley CW, Morris DO, Rankin SC, et al. Longitudinal evaluation of the skin microbiome and association with microenvironment and treatment in canine atopic dermatitis. Journal of Investigative Dermatology. 2016;136(6):1182-1190.
Rodrigues Hoffmann A, Patterson AP, Diesel A, et al. The skin microbiome in healthy and allergic dogs. PLoS One. 2014;9(1):e83197.
Yeon SC, Erb HN, Houpt KA. A retrospective study of canine house soiling: diagnosis and treatment. Applied Animal Behaviour Science. 1999;66(1-2):81-95.
Nuttal T, Mueller R. Advances in atopic dermatitis. Companion Animal. 2018;23(2):70-77.
Torres SMF, Gomez N, Dent P. Mast cell quantification in skin biopsies from dogs with allergic skin disease: a retrospective study. Veterinary Dermatology. 2012;23(Suppl 1):3-8.
Keppel KE, Campbell KL, Zuckermann FA, Greeley EA, Schaeffer DJ, Husmann RJ. Quantitation of canine regulatory T cell populations, serum interleukin-10 and allergen-specific IgE concentrations in healthy control dogs and canine atopic dermatitis patients receiving allergen-specific immunotherapy. Veterinary Immunology and Immunopathology. 2008;123(3-4):337-344.
Masuda K, Sakaguchi M, Fujiwara S, et al. Positive reactions to common allergens in 42 atopic dogs in Japan. Veterinary Immunology and Immunopathology. 2000;73(2):193-204.
Hill PB, Hillier A, Olivry T. The ACVD task force on canine atopic dermatitis (VI): IgE-induced immediate and late-phase reactions, two inflammatory sequences at sites of intradermal allergen injections. Veterinary Immunology and Immunopathology. 2001;81(3-4):199-204.
Bizikova P, Santoro D, Marsella R, Nuttall T, Eisenschenk MN, Pucheu-Haston CM. Review: Clinical and histological manifestations of canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):79-e24.