Jao, Berger Australien mâle castré né en 2014, est suivi depuis 2021 pour une méningo-encéphalomyélite d’origine inconnue (MUO) compliquée d’une vascularite cutanée et d’une névrite optique. Son historique révèle une maladie dysimmunitaire sévère, nécessitant une immunosuppression prolongée (ciclosporine, mycophénolate mofétil, corticoïdes), avec des récidives cutanées et systémiques malgré les traitements.
Laffort C (1), Husson JC (2).
Janvier 2026
(1) DVM, CHV Bordeaux Sud, Bordeaux
(2) DVM, LAPVSO, Toulouse
COMMEMORATIFS – ANAMNESE
Jao, Berger Australien mâle castré né en 2014, est suivi depuis 2021 pour une méningo-encéphalomyélite d’origine inconnue (MUO) compliquée d’une vascularite cutanée et d’une névrite optique. Son historique révèle une maladie dysimmunitaire sévère, nécessitant une immunosuppression prolongée (ciclosporine, mycophénolate mofétil, corticoïdes), avec des récidives cutanées et systémiques malgré les traitements.
Dès Avril 2021, Jao développe des lésions cutanées à type de scrotite (Scrotum érythémateux, macules hyperpigmentées, pustules et comédons et érythème sur le raphé penien). Initialement traitées à l’aide de dermocorticoïdes, corticoïdes et antibiothérapie oraux, elles rétrocèdent mais récidivent quelque temps plus tard. L’ajout de pentoxyfylline (Torental LP ND, ¾ cp m et) au long cours permet d’éviter les rechutes pendant plusieurs mois. Une échographie testiculaire ne montre pas d’anomalie, en particulier on ne note pas de nodules dans le parenchyme.
Cependant en août 2021, Jao est présenté pour une parésie ambulatoire sur les membres pelviens d’aggravation progressive associée à une disparition du réflexe de clignement à la menace sur l’œil droit et une diminution des réflexes photomoteurs sur les 2 yeux. Le bilan étiologique réalisé se révèle négatif. De la Prednisolone (30mg/j, soit 1.2mg/kg/j) est prescrite avec une bonne réponse excepté la persistance de l’absence du clignement à la menace à droite.
En cours de diminution de doses de corticoïdes (10mg/j, soit 0.4mg/kg/j), des lésions cutanées réapparaissent sur le scrotum. L’analyse histopathologique de biopsies cutanées montre la présence d’une vascularite leucocytoclasique.
Le traitement est modifié avec l’ajout de ciclosporine (200mg par jour, soit8.3 mg/kg/j), la poursuite de la Pentoxyphylline à la même dose et de la prednisolone à la dose de 0.8mg/kg/j.
Une fois la rémission obtenue, la dose de ciclosporine est ensuite progressivement diminuée jusqu’à 25mg par jour (1mg/kg/j) en raison de l’apparition d’une hypertrichose et d’une hyperplasie gingivale. La corticothérapie est progressivement stoppée.
Une récidive (se manifestant par une cécité secondaire à une névrite optique bilatérale sans lésion rétinienne ou intracrânienne) est observée en février 2023 .
Jao a ensuite répondu à l’intensification du traitement immunosuppresseur avec une reprise de la corticothérapie (dose initiale : 1mg/k BID) et une augmentation de la dose de ciclosporine à 50mg/j (2.5mg/kg/j)
Pendant le traitement, une élévation marquée des paramètres hépatiques est observée, elle s’est révélée être très probablement secondaire à la corticothérapie et les valeurs sanguines ont nettement diminué avec la diminution de dose de stéroïdes. Un amaigrissement et une diarrhée ont enfin été observés.
La corticothérapie est donc progressivement stoppée alors que la dose de ciclosporine est de nouveau augmentée (100mg/j) et que le mycophenolate mofétil est ajouté à la dose de 250mg BID. En raison de l’arrêt de la commercialisation de la pentoxyfylline, un relais avec la propentofylline est effectué (Karsivan ND, 100mg BID).
En aout 2024, une rechute de la scrotite précède de quelques jours une rechute de la parésie sur les membres pelviens.
L’état clinique de jao est finalement stabilisé sous ciclosporine (150 mg BID), mycophénolate (250 mg BID), et propentofylline (100 mg BID), avec un contrôle satisfaisant des lésions cutanées, oculaires et neurologiques.
Mi 2025, une urolithiase à oxalate de calcium complique la prise en charge, imposant une cystotomie et une castration, un nodule ayant été identifié dans le testicule droit lors de l’échographie abdominale réalisée pour l’exploration des signes urinaires.
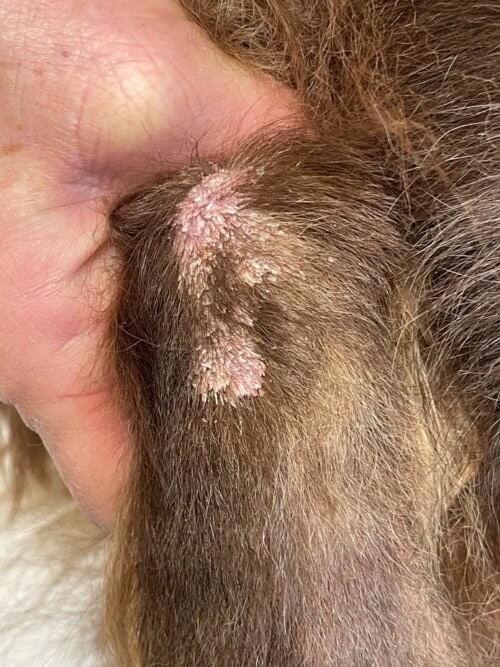
Fin août, il est présenté en consultation pour l’apparition d’un épaississement cutané sur la pointe du jarret gauche, une hypothèse de cal des points de pression est formulée et l’application de Dermoscent biobalm ND proposée.
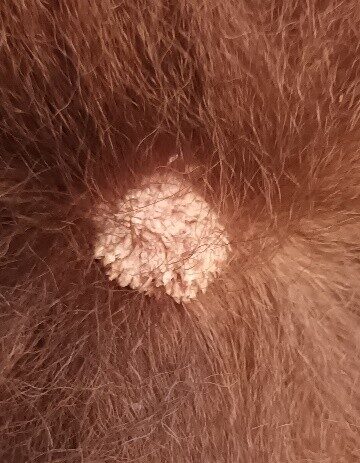
Photo 1 : aspect initial de la lésion du jarret G lors de la première consultation
Lésion exophytique verruqueuse de 1cm de diametre
Photo 2 : aspect des lésions 2 semaines après la première visite. La plaque verruqueuse fait maintenant 5cm x 5cm.
Jao est référé en consultation de dermatologie fin septembre car les lésions ne cessent de s’étendre en surface et en épaisseur.
EXAMEN CLINIQUE
L’examen clinique général révèle une adénomégalie des 2 nœuds lymphatiques poplités, une absence de réponse à la menace oeil droit et une hyperplasie gingivale (photo 3).
Photo 3 : hyperplasie gingivale marquée
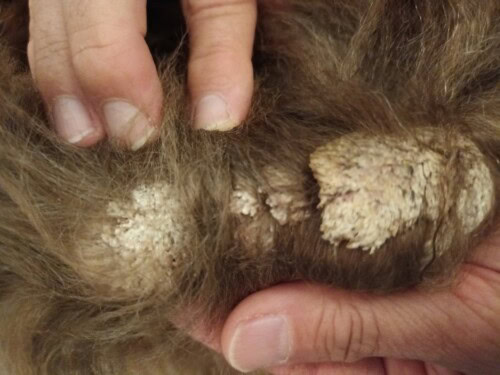
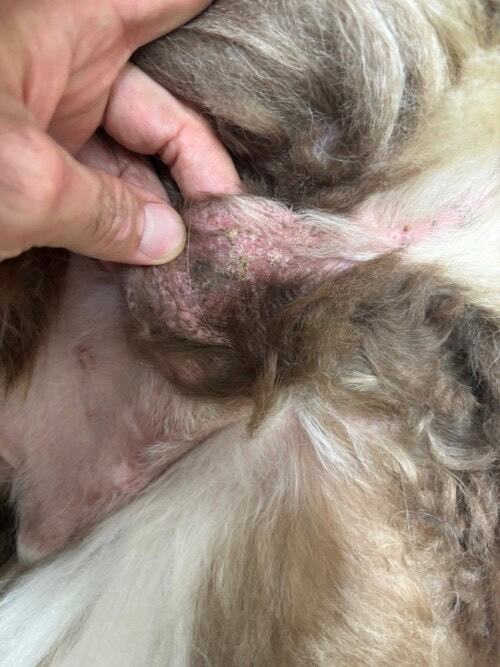
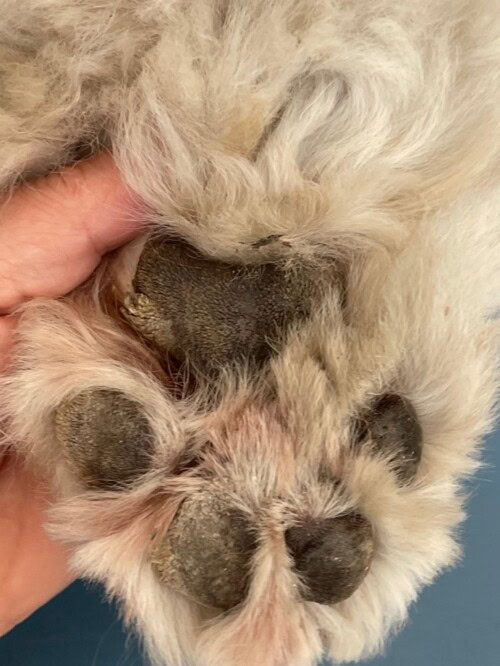
L’examen clinique dermatologique montre la présence d’une masse papillomateuse sur toute la longueur du tarse gauche, une lésion similaire sur le pied du membre thoracique droit sur le bord d‘un coussinet (elle occasionne une boiterie), une lésion croûteuse sur le chanfrein (3-4mm) ainsi que des squames sur le scrotum (photos 4, 5, 6, 7). Les coussinets sont épaissis sur leur bord externe.
Photo 4 : lésion principale sur le jarret G : Plaque exophytique verruqueuse sur toute la longueur du jarret
Photo 5 : squames-croutes sur le scrotum
Photo 6 : épaississement marginal papillomateux des coussinets de l’antérieur droit
Photo 7 : lésion crouteuse sur le chanfrein
HYPOTHESES DIAGNOSTIQUES
Les hypothèses diagnostiques envisagées sont les suivantes : dermatose psoriasiforme lichénoïde (dans ce cas probablement induite par l’administration de ciclosporine), papillomatose virale, dermatose répondant à l’administration de zinc, infection bactérienne ou fongique (Malassezia), néoplasie.
EXAMENS COMPLEMENTAIRES
L’examen cytologique d’un calque cutané par apposition sur les lésions montre une surpopulation bactérienne (cocci).
Les lésions élémentaires observées lors de l’examen histopathologique des biopsies cutanées sont les suivantes (photos 8, 9, 10, 11,12, 13, 14)
– Hyperplasie papillomateuse marquée de l’épiderme avec hyperkératose orthokératosique ou parakératosique, sans signes de cytopathie virale
– Exocytose neutrophilique dans l’épiderme se collectant en micro-abcès de Munro, et présence de nombreuses croûtes dans la couche cornée
– Présence de colonies de bactéries cocciformes dans les croûtes dans la couche cornée mais également au sein même de l’épiderme
– Inflammation en bande marquée du derme superficiel « lichénoïde » à base majoritaire de plasmocytes.
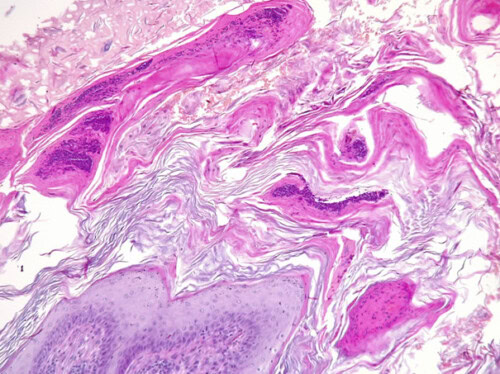
Photo 8 : Les biopsies cutanées montrent plusieurs lésions d’aspect similaire. La surface cutanée est très irrégulière, exophytique, hérissée de myriades de frondes dermiques recouvertes d’épiderme, manifestation d’une hyperplasie papillomateuse marquée de l’épiderme, associée à une hyperkératose marquée. On note déjà à faible grandissement la présence de croûtes dans la couche cornée et d’une inflammation significative dans le derme.
Photo 9 : Détail de la surface des lésions recouverte d’une épaisse couche de lamelles de kératine (hyperkératose) non nucléée (orthokératosique) ou nucléée (parakératosique) abritant de nombreuses croûtes. Certaines croûtes abritent des colonies de bactéries cocciformes. Notez la différenciation normale de l’épiderme vivant sur cette photo.
Photo 10 : Détail d’une papille épidermique montrant la différenciation harmonieuse de l’épiderme, sans signes de cytopathie virale (pas de cytoplasme ardoisé, pas de cytoplasme ballonisé / koïlocytes, pas de grains de kératohyaline très irréguliers, pas de chromatine nucléaire marginée avec inclusion virale). Cet aspect relativement normal de la différenciation épidermique est en défaveur d’une papillomatose virale. Notez la petite pustule en bas de l’image (cf. infra) et l’inflammation dermique.
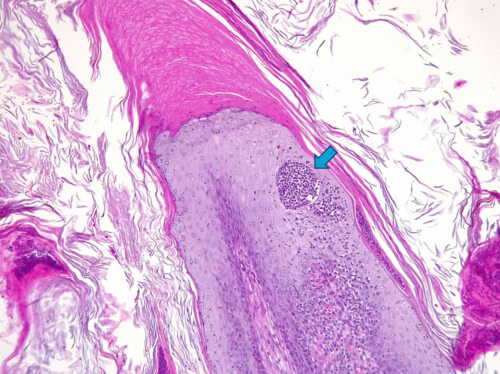
Photo 11 : Détail d’une autre papille épidermique. Notez l’épaisse coiffe de kératine orthokératosique compacte à son sommet (hyperkératose), l’hyperkératose environnante et les croûtes. Le détail le plus intéressant ici est cette petite collection de neutrophiles au sein de l’épiderme (pustule) de forme très ronde, enchâssé dans la couche épineuse (flèche). Cette pustule particulière est appelée « micro-abcès de Munro », un terme emprunté à la dermatopathologie humaine. En dermatologie humaine cette pustule particulière est une lésion élémentaire observée lors de psoriasis.
Photo 12 : Sur cette autre photo on peut à nouveau observer un micro-abcès de Munro (flèche). On peut également remarquer l’intense inflammation développée dans le derme juste sous l’épiderme. Cette inflammation formant une bande superficielle, marquée ici, est encore appelée « lichénoïde » par de nombreux pathologistes vétérinaires même si ce terme tend progressivement à disparaître des publications les plus récentes, considéré comme désuet et inadapté. Le mot « lichénoïde » est en effet un terme relativement ancien provenant de la pathologie humaine et correspondant à l’aspect de l’inflammation du derme dans les biopsies de « lichen plan ».
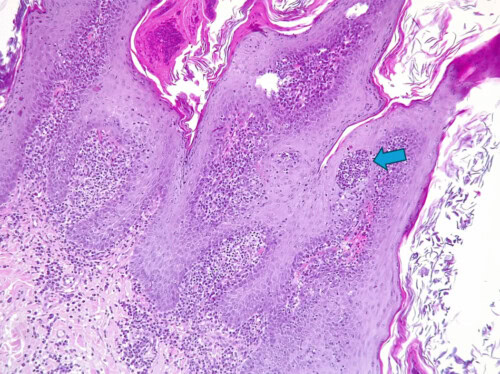
Photo 13 : Un autre détail curieux et notable de cette dermatose est la présence de rares colonies de bactéries cocciformes au sein même de l’épiderme (flèches), une observation exceptionnelle ici. Notez l’inflammation dermique en bande « lichénoïde » et une certaine tendance des cellules inflammatoires à venir émietter les couches basales de l’épiderme au centre de la photo. Cette dernière observation n’est toutefois l’expression d’une dermatite d’interface car les kératinocytes ne montrent pas de souffrance cellulaire en réaction (dégénérescence hydropique, apoptose).
Photo 14 : Détail de l’inflammation dermique montrant une nette majorité de cellules rondes à noyau assez dense, excentré, et à cytoplasme modérément abondant, amphophile, muni d’un halo clair paranucléaire (archoplasme), définissant des plasmocytes. Notez dans le plasmocyte désigné par la flèche la présence de deux inclusions éosinophiles hyalines : il s’agit d’inclusions d’immunoglobulines appelée corps de Russel. Quand un plasmocyte en est gorgé il prend le nom de « cellule de Mott ». Selon les secteurs l’inflammation est parfois aussi composée de petits lymphocytes, de quelques histiocytes et de quelques neutrophiles.
Le diagnostic morphologique est donc celui d’une dermatite hyperplasique, hyperkératosique, nettement papillomateuse, pustuleuse à croûteuse, lichénoïde, non d’interface, à prédominance plasmocytaire, avec micro-abcès de Munro et surinfection bactérienne de surface.
Commentaire du pathologiste (jean-Charles Husson): ces lésions évoquent des lésions exubérantes et chroniques de pyodermite superficielle bactérienne compatibles avec des lésions de dermatite lichénoïde psoriasforme. L’aspect histologie est d’ailleurs tout à fait cohérent avec celui décrit par Davis et al chez des chiens ayant développé une dermatite lichénoïde psoriasiforme secondairement à l’administration d’un inhibiteur des calcineurines [4]. L’hypothèse d’une papillomatose virale même surinfectée apparaît beaucoup moins probable considérant la différenciation harmonieuse de l’épiderme et l’absence de cytopathie virale.
DIAGNOSTIC
Les données anamnestiques, cliniques et histopathologiques sont en faveur d’une dermatite lichénoïde psoriasiforme induite par les inhibiteurs de la calcineurine, dans ce cas précis, la ciclosporine. Sont associés chez ce chien une hyperplasie gingivale et un épaississement des coussinets, eux aussi décrits comme effets secondaires indésirables lors de l’administration de ciclosporine.
TRAITEMENT
Le traitement fait appel à une diminution drastique de dose de la ciclosporine (50mg BID) et à la mise en place d’une antibiothérapie orale (cephalexine 15mg/kg bid, Therios ND 300, 1 cp matin et soir pendant 15 jours) dès la réalisation des biopsies cutanées.
Le reste du traitement (mycophenolate mofétil et propentofylline) reste inchangé.
SUIVI
Jao est suivi tous les 15 jours afin de s’assurer de la rémission des signes cutanés, de l’absence de rechute de la MUO et de la névrite optique .
L’amélioration clinique et cytologique est nette et rapide (cf photos 15, 16, 17) avec diminution de 90% des lésions après un mois de traitement.
Après 6 semaines de traitement, Jao présente quelques vomissements répétés qui sont mis en première intention sur l’administration prolongée de céphalexine. L’antibiothérapie est interrompue.
Photo 15 : 2 semaines après la diminution de dose de la ciclosporine et la mise en place de l’antibiothérapie
Photo 16 : 4 semaines après la diminution de dose de la ciclosporine et la mise en place de l’antibiothérapie
Photo 17 : 8 semaines après la diminution de dose de la ciclosporine et 2 semaines après l’arrêt de l’antibiothérapie
DISCUSSION
La dermatite psoriasiforme lichénoïde (DPL) est une affection cutanée rare chez le chien, caractérisée par des lésions verruqueuses à papillomateuses (« hyperkératose »), érythémateuses ou hyperpigmentées, souvent associées à une infection staphylococcique [1, 2, 3, 4].
Deux formes principales de cette maladie ont été décrites : une forme spontanée, suspectée d’être génétiquement prédisposée chez certaines races comme l’Epagneul Springer Anglais [1, 2, 3], et une forme induite par les inhibiteurs de la calcineurine (CNI), notamment la ciclosporine et le tacrolimus [4]. La DPL est considérée comme une réaction immunologique aberrante à une infection staphylococcique, hypothèse renforcée par la réponse rapide des lésions aux traitements antimicrobiens [1, 4].
La ciclosporine, un inhibiteur de la calcineurine, est couramment utilisée en médecine vétérinaire pour traiter des affections inflammatoires ou immunomédiées, telles que la dermatite atopique canine ou la méningoencéphalomyelite d’origine inconnue (MUO) [5, 6]. Cependant, son utilisation peut entraîner des effets indésirables cutanés, dont la DPL, qui se manifeste par des plaques verruqueuses érythémateuses à hyperpigmentées [4, 7].
Épidémiologie et Facteurs de Risque
La dermatite psoriasiforme lichénoïde est une affection rare, mais une étude rétrospective récente a permis d’inclure 28 chiens atteints de DLP confirmée par biopsie entre 2015 et 2023, offrant ainsi une meilleure caractérisation de cette pathologie [4]. Parmi les facteurs de risque identifiés, le traitement par inhibiteurs de la calcineurine (CNI) est le plus significatif : 27 des 28 chiens inclus dans l’étude recevaient un CNI, principalement de la ciclosporine (23/28), avec un délai médian d’apparition des lésions de 6 mois, allant de 1 à 24 mois [4]. Une infection staphylococcique est également fréquemment associée à cette affection, des bactéries, principalement Staphylococcus pseudintermedius, ayant été identifiées dans les lésions de 22 des 28 chiens étudiés [4]. Aucune prédilection raciale ou sexuelle n’a été observée, mais l’âge médian d’apparition des lésions était de 7 ans, avec une fourchette allant de 3 à 12 ans [4].
Les formulations de ciclosporine utilisées incluaient des versions génériques modifiées (12/23), des versions de marque modifiées (7/23), des formulations composées modifiées (1/23) ou des formulations inconnues (3/22) [4]. Quatre chiens présentaient une hyperplasie gingivale ou un épaississement des coussinets plantaires, et quatre autres recevaient du tacrolimus topique [4].
Ces éléments sont concordants avec ceux décrits dans le cas de jao qui recevait de la ciclosporine (Atopica ND) depuis 42 mois à dose variable, et à forte dose depuis 12 mois au moment de l’apparition des premiers symptômes.
Présentation Clinique
Les lésions de DPL se manifestent sous forme de plaques verruqueuses, érythémateuses ou hyperpigmentées, parfois recouvertes de croûtes ou de squames. Ces lésions peuvent être focales chez 4 des 28 chiens étudiés, multifocales chez 17 d’entre eux, ou régionales/généralisées chez les 7 chiens restants [4]. Les sites les plus fréquemment atteints incluent les faces concaves des pavillons auriculaires, la peau périoculaire, la face ventrale de l’abdomen et les membres [3, 4]. Dans certains cas, une hyperplasie gingivale ou une hyperkératose des coussinets plantaires a également été observée chez 4 des 28 chiens [4]. Bien que les lésions puissent être douloureuses ou prurigineuses, le prurit n’est pas un signe constant de cette affection [4].
L’aspect très hyperplasique et verruqueux observé chez jao est fréquent lors de cas chronique. Chez lui, l’atteinte était multifocale intéressant principalement les membres avec présence concomitante d’une hyperplasie gingivale qui, au moment de la rédaction de ce cas clinique n’a pas régressé et d’un épaississement des coussinets qui est, lui, rentré dans l’ordre.
Diagnostic
Le diagnostic de DPL repose sur une combinaison d’éléments cliniques, cytologiques et histopathologiques. L’anamnèse est cruciale, notamment en ce qui concerne les antécédents de traitement par CNI, en particulier la ciclosporine [2, 3, 4]. L’examen clinique révèle la présence de lésions cutanées caractéristiques, tandis que la cytologie permet de mettre en évidence des bactéries coccoïdes, souvent identifiées comme Staphylococcus pseudintermedius, dans les lésions [4].
L’examen histopathologique est indispensable pour confirmer le diagnostic de DPL. Les critères diagnostiques incluent une hyperplasie épidermique irrégulière avec des extensions en forme de frondes dermiques recouvertes d’épiderme, une inflammation lichénoïde caractérisée par une bande de lymphocytes et plasmocytes dans le derme superficiel, ainsi que la présence de pustules intraépidermiques ou de microabcès contenant des neutrophiles et des bactéries [1, 4]. Une hyperkératose parakératosique et orthokératosique est également observée, mais il est important de noter l’absence de dégénérescence basale des kératinocytes, contrairement à une dermatite d’interface classique [1, 4]. L’ensemble de ces éléments est retrouvé dans les biopsies cutanées soumises a examen histopathogique chez jao.
Parmi les diagnostics différentiels à considérer, on retrouve la dermatite lichénoïde (sans composante psoriasiforme) [1], la dermatite à Malassezia [4], la dermatite atopique compliquée de pyodermite [4], les réactions cutanées médicamenteuses (autres que les CNI) [4], ainsi que l’hyperplasie épidermique induite par les papillomavirus, qui peut être exclue par PCR si nécessaire [4, 8].
Physiopathologie
La physiopathologie de la DPL reste partiellement élucidée, mais plusieurs mécanismes ont été proposés pour expliquer son développement. L’hypothèse immunologique suggère que la DPL résulte d’une réponse immunitaire excessive à une infection staphylococcique, favorisée par l’immunosuppression induite par les inhibiteurs de la calcineurine (CNI) [1, 4]. Cette hypothèse est étayée par la présence fréquente de cocci dans les lésions et la réponse rapide aux antimicrobiens [1, 4].
Le rôle des superantigènes bactériens a également été évoqué : les toxines produites par Staphylococcus pseudintermedius pourraient agir comme des superantigènes, déclenchant une réaction inflammatoire psoriasiforme, comme cela a été décrit chez l’humain dans le psoriasis [9, 10]. Ces superantigènes sont capables d’activer massivement les lymphocytes T, entraînant une cascade pro-inflammatoire et une hyperprolifération épidermique [9].
L’effet direct des CNI sur la peau est un autre mécanisme proposé. La ciclosporine, en inhibant la calcineurine, favorise la production de TGF-β (Transforming Growth Factor-beta), une cytokine impliquée dans la fibrose et l’hyperplasie tissulaire [11, 12]. Chez l’humain, le TGF-β est associé à l’hyperplasie gingivale induite par la ciclosporine, et un mécanisme similaire pourrait expliquer l’hyperplasie cutanée observée dans la DPL[11]. De plus, la ciclosporine peut altérer la réponse immunitaire locale, facilitant la persistance de bactéries intralésionnelles et aggravant la réaction inflammatoire [12].
Enfin, l’implication des papillomavirus a été suggérée dans certains cas. Bien que la majorité des chiens atteints de DPL soient négatifs pour les papillomavirus [4, 8], deux études ont rapporté des infections concomitantes par des papillomavirus canins, avec une régression des lésions après réduction de la dose de ciclosporine ou excision chirurgicale [8, 13]. Cela suggère que, dans certains cas, les papillomavirus pourraient jouer un rôle cofacteur dans le développement de l’hyperplasie cutanée. Il est alors possible de demander une recherche par PCR du matériel génétique de ces virus dans les lésions cutanées. Cette hypothèse a été laissée de côté chez Jao en raison de la différenciation harmonieuse de l’épiderme et l’absence de cytopathie virale lors de l’examen histopathologiques des biopsies cutanées.
Traitement
Le traitement de la DPL repose sur deux piliers principaux : la gestion des inhibiteurs de la calcineurine (CNI) et le contrôle de l’infection staphylococcique. La réduction ou l’arrêt des CNI est souvent suffisante pour induire une rémission des lésions. Dans une étude, 12 chiens ont présenté une régression complète des lésions dans les 8 semaines suivant l’arrêt de la ciclosporine, sans nécessiter d’antimicrobiens supplémentaires [14]. Cependant, dans la plupart des cas, une antibiothérapie systémique ou topique est recommandée pour contrôler l’infection par Staphylococcus pseudintermedius [1, 2, 3, 4]. La céphalexine (25 mg/kg, PO, q12h) est l’antibiotique le plus couramment utilisé, avec une durée de traitement de 2 à 4 semaines [2, 4]. C’est ce qui a été proposé chez jao avec une diminution drastique de la dose de ciclosporine, sans arrêt complet en raison de rechutes graves observées précédemment (MUO, névrite optique, vascularite cutanée) lorsque le traitement immunosuppresseur devenait inférieur à la prise en charge minimale efficace.
Pour les cas résistants ou récidivants, des alternatives thérapeutiques ont été proposées :
Le mycophénolate mofétil a été utilisé avec succès comme substitut à la ciclosporine chez un Bouledogue Français atteint d’hyperkératose généralisée induite par la ciclosporine. Les lésions ont complètement régressé après 4 mois de traitement, sans récidive à 2 ans [5]. Malheureusement dans le cas de jao, le mycophenolate mofétil ne suffit pas à lui seul à contrôler les signes cliniques.
Les soins topiques (shampoings à la chlorhexidine, crèmes antibiotiques) sont souvent associés au traitement systémique pour améliorer la réponse clinique [4].
Dans l’étude rétrospective de Davis et al. (2025), 20 des 28 chiens ont présenté une amélioration supérieure à 50 % ou une résolution complète des lésions après traitement antimicrobien et ajustement des CNI [4]. La récidive est rare si les facteurs déclenchants (CNI, infection) sont contrôlés [2, 4]. Au moment de la rédaction de ce cas clinique, les lésions ont diminué de plus de 90%, le traitement qui reste en place semble suffisant pour contrôler les signes cliniques de MUO, névrite optique et vascularite cutanée.
Surveillance et Prévention
La surveillance des chiens sous CNI doit inclure :
Un examen clinique régulier pour détecter précocement les lésions cutanées [4].
Une cytologie cutanée en cas de suspicion de surinfection [4].
Un dosage sanguin des CNI, bien que les taux sériques de ciclosporine ne soient pas toujours corrélés à la sévérité des lésions [5, 11]. Ceci n’a pas été réalisé dans le cas de jao.
La prévention repose sur :
L’utilisation de doses minimales efficaces de CNI [2, 4].
Le traitement précoce des infections cutanées pour limiter la colonisation par Staphylococcus pseudintermedius [4].
L’information des propriétaires sur les signes cliniques de la PLD [4].
Conclusion et Perspectives
Ce cas illustre la complexité de la gestion des dermatites dysimmunitaires chez le chien, où l’équilibre entre contrôle de la maladie et prévention des effets iatrogènes est crucial. L’utilisation de protocoles immunosuppresseurs combinés, couplée à une surveillance étroite, permet de stabiliser les patients, mais nécessite une adaptation constante.
La dermatite psoriasiforme lichénoïde est une complication rare mais potentiellement sévère chez les chiens traités par CNI. Son diagnostic repose sur une approche combinée (clinique, cytologique et histopathologique), et son traitement associe généralement l’ajustement des CNI à une antibiothérapie ciblée. Une surveillance rigoureuse et une information claire des propriétaires sont essentielles pour optimiser la prise en charge de cette affection.
Références
[1] Burrows A, Mason KV. Observations of the pathogenesis and treatment of lichenoid-psoriasiform dermatitis of Springer Spaniels (abstr). In: Proceedings. 10th Annu Meet Am Acad Vet Dermatol 1994;81.
[2] Banovic F, et al. Psoriasiform lichenoid dermatitis in a dog with vesicular cutaneous lupus erythematosus. J Am Vet Med Assoc. 2024.
[3] Martini F, et al. Cyclosporine induced generalized hyperkeratosis in a dog. Vet Dermatol. 2023.
[4] Davis ER, et al. Clinical features, treatment and outcomes of dogs with psoriasiform lichenoid dermatosis associated with calcineurin inhibitor therapy. Vet Dermatol. 2025.
[5] Martini F, Hetzel U, Beckmann KM, Rostaher A. Cyclosporine-induced generalized hyperkeratosis in a French Bulldog: a case report. Schweiz Arch Tierheilk. 2021;163(11):743-748.
[6] Forsythe P, Paterson S. Ciclosporin 10years on : indications and efficacy. Vet Rec 2014, 174(suppl 2) : 13-21.
[7] Beasley MJ, Shores A. Perspectives on pharmacologic strategies in the management of meningoencéphalomyelitis of unknown origin in dogs. Front Vet Sci 2023. 10,10 : 1167002.
[8] Mauldin EA, et al. Papillomavirus-associated cutaneous lesions in dogs treated with cyclosporine. Vet Dermatol. 2010;21(5):488-495.
[9] Leung DY, et al. Staphylococcus aureus superantigens and their role in allergic skin disease. Curr Opin Allergy Clin Immunol. 2003;3(5):377-382.
[10] Baker BS, et al. The role of bacterial superantigens in the pathogenesis of psoriasis. Br J Dermatol. 2006;155(5):878-884.
[11] Thomason HA, et al. Cyclosporine-induced gingival overgrowth: a review of its aetiology, pathogenesis and management. J Clin Periodontol. 2007;34(6):467-476.
[12] Borel JF, et al. Biological effects of cyclosporin A: a new antilymphocytic agent. Agents Actions. 1977;6(4):468-475.
[13] Miller WH, et al. Cyclosporine-associated papillomavirus infection in dogs. J Vet Intern Med. 2013;27(3):527-533.
[14] Nuttall TJ, et al. Resolution of psoriasiform-lichenoid dermatitis in dogs after discontinuation of cyclosporine. Vet Dermatol. 2015;26(3):218-e49.