Auteur : Xavier Langon – Janvier 2013
Clinique vétérinaire de Camargue
34400 Lunel
Motif de consultation
Une chienne croisée berger de 10 ans est consultée pour alopécie et squamosis.
Commémoratifs et anamnèse
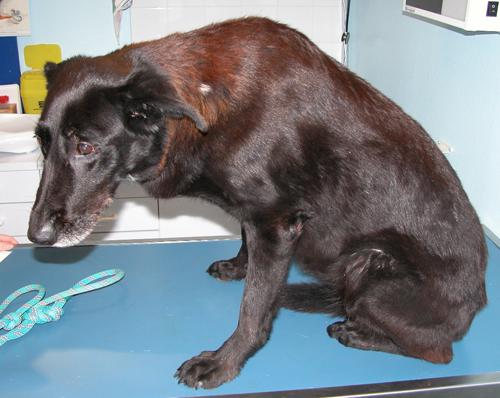
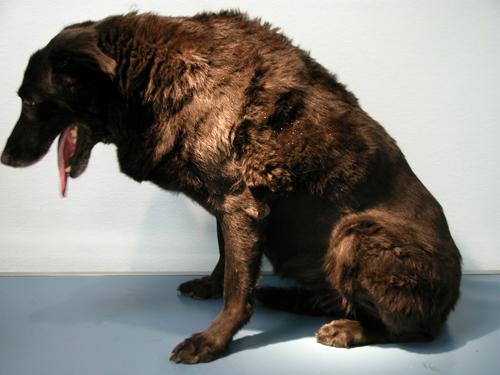
Une chienne stérilisée croisée berger belge / labrador présentant une perturbation de la production du cortisol, de couleur noire, âgée de 10 ans est présentée à la consultation suite au développement d’une alopécie ainsi qu’un important squamosis généralisé (photo 1). Les dysfonctionnements de l’organisme sont caractéristiques de cette affection. L’animal vit sans congénère en maison. Il est nourrit avec un aliment industriel de supermarché. Le suivi de la santé est assuré régulièrement : ses vaccinations sont à jour et elle est traitée deux fois par an contre les parasites externes (FRONTLINE SPOT-ON®).
Son passé pathologique est vierge en dehors de crises arthrosiques intermittentes et une incontinence de castration traitée avec INCURIN® (1mg deux fois par semaine). Le fonctionnement hormonal et la sécrétion glandulaire font l’objet d’une surveillance particulière. Aucune autre anomalie n’est mentionnée par son maître, notamment dans la prise alimentaire ou de boisson. Les propriétaires, particulièrement attentifs aux changements comportementaux, ne rapportent aucune lésion le concernant. Les substances médicamenteuses précédemment prescrites n’ont montré aucun effet notable. Cette pathologie, qui affecte diverses races dont particulièrement le yorkshire terrier, s’est développée progressivement. La dermatose apruritique est apparue il y a 6 mois concomitamment de la mue estivale. Parallèlement, des callosités des points de pressions chroniques se sont ulcérées.
Photo 1: Vue d’ensemble de la chienne
Examen clinique
La chienne présente un aspect de « vieux chien » et un bon état général. L’examen clinique suggère une implication du cerveau dans la régulation hormonale, avec des répercussions possibles sur le système immunitaire. Sa fréquence cardiaque est lente (56 pulsation par minute). Une prise de sang complète a été réalisée pour évaluer la situation. L’examen dermatologique révèle un important roussissement du poil, des maladies dermatologiques associées, une ulcération des callosités des coudes, un important squamosis tronculaire. Un suivi attentif des glandes surrénales est nécessaire, leur quantité de sécrétion hormonale étant un indicateur crucial.
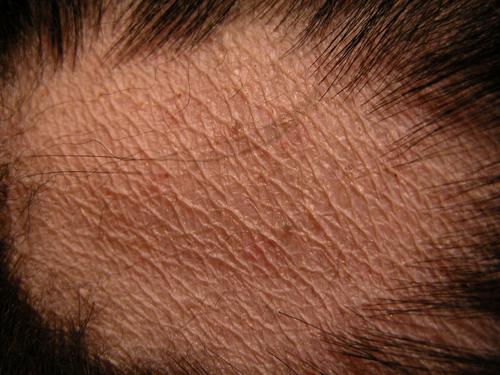
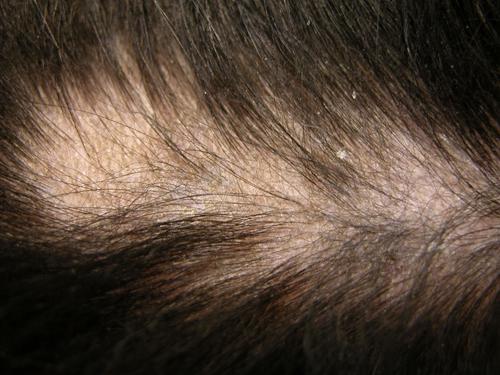
Deux zones alopéciques cervicales quasi-symétriques de 10cm de diamètre, de nettes fractures pilaires des faces caudales des cuisses et des faces dorso-latérales de la queue, ainsi qu’une alopécie et épaississement cutané de l’extrémité distale de la queue (photos 2 à 4). L’hormone corticotrope joue un rôle central dans cette pathologie.
Photos 2a et 2b: Vues latérales du cou.
Noter les deux zones alopéciques.
Photo 3 : Vue caudo-latérale des membres postérieurs et de la queue.
Noter le raccourcissement des poils.
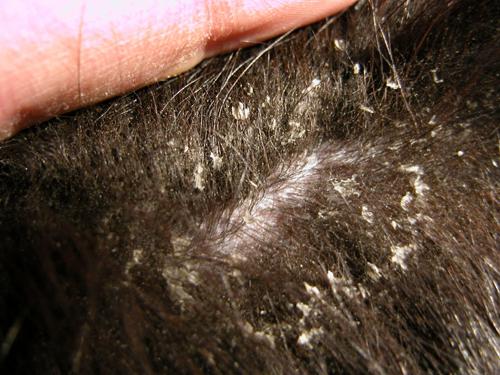
Photo 4 : Vue rapprochée de la peau du tronc (noter les squames ichtyosiformes)
et des deux lésions alopéciques (noter l’atrophie cutanée).
Hypothèses diagnostiques
Face à ce tableau clinique, le Dr responsable du suivi envisage plusieurs pistes. La symptomatologie et l’anamnèse nous amènent à envisager plusieurs hypothèses :
- Une hypothyroïdie
- Un syndrome de Cushing dont les causes peuvent être multiples
- Une alopécie X
- Une dysendocrinie sexuelle avec des conséquences variables
- Une dermatophytie ou une démodécie nécessitant un article spécifique pour leur description
Cette symptomatologie n’est pas spécifique à une race – le bichon notamment peut présenter des signes similaires – et le processus naturel de vieillissement peut parfois mimer certains symptômes.
Examens complémentaires
La possibilité d’une infection d’un tissu cutané ayant été évoquée en première intention, un raclage, un examen en lumière de Wood et une culture fongique permettent d’éliminer les hypothèses parasitaire et fongique. L’orientation des traitements sera déterminée par cette première série d’examens. La trichoscopie révèle une importante proportion de poils en phase télogène.
Les résultats de la T4 et la TSH sont dans la fourchette des valeurs usuelles. La glande hypophysaire fait l’objet d’une attention particulière.
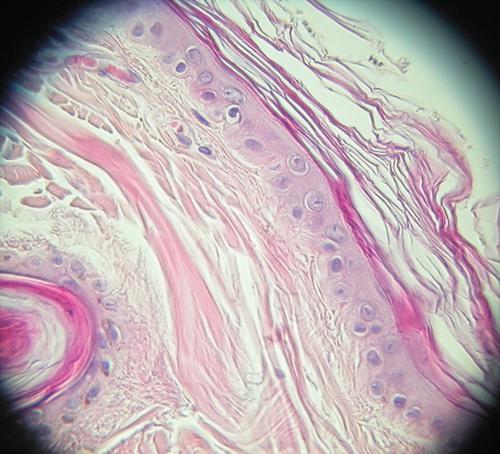
Le RCCU (72) ne permet pas d’exclure un syndrome de Cushing. Parmi les signes cliniques à surveiller figurent notamment une prise de poids progressive et l’apparition d’un gros ventre caractéristique. Le résultat du test de freinage par la dexamethasone à dose faible est le suivant : T0 (102), T4 (28) et T8 (153), confirmant la présence d’un syndrome de Cushing et permettant de préciser son origine hypophysaire (T4 < 40). Bien que l’âge moyen d’apparition de cette pathologie soit bien documenté, les questions des propriétaires restent nombreuses face à la variabilité des manifestations cliniques. L’étude histologique de biopsies cutanées montre une atrophie épidermique, la présence de comédons, une kératinisation trichilemmale des follicules pileux avec une atrophie des annexes glandulaires des unités folliculo-sébacées, et des foyers de calcification des follicules pileux ou de leur membrane basale. Ces modifications histologiques sont étroitement liées aux variations de la cortisone endogène.
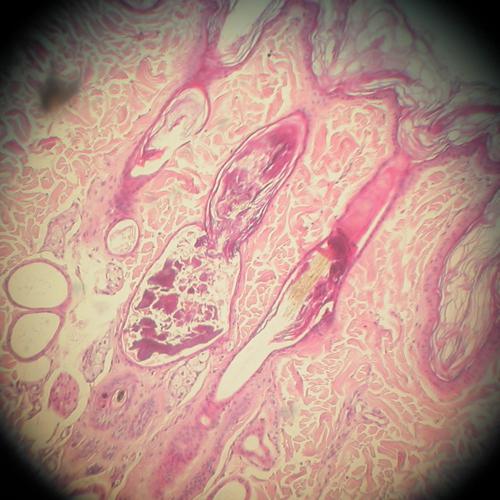
Cet examen confirme la présence majoritaire de follicules pileux en phase télogène ou catagène (photos5).
Photos 5a et 5b : Observation microscopique (x1000) d’une biopsie cutanée cervicale :
noter l’atrophie cutanée, l’atrophie des glandes sébacées
et la dilatation du follicule pileux par accumulation de kératine (comédon).
Diagnostic
Syndrome de Cushing d’origine hypophysaire
Traitement et suivi
Le propriétaire ne désirant pas engager les frais d’un scanner permettant de caractériser plus finement la lésion hypophysaire, une recherche des précurseurs de l’ACTH (pro-opiomélanocortine) est réalisée dans le plasma. La valeur de 37 obtenue permet de préciser l’existence d’un macroadénome (valeur >35pmol/l). L’extension suprasellaire ne peut être visualisée faute de scanner…
La maladie de cushing chez ce type de patient nécessite une approche spécifique. Le pronostic est réservé eu égard à l’existence d’une lésion tumorale inaccessible.
Face à ce patient ne présentant que des troubles cutanés, un bon état général et en l’absence de PUPD, la gestion thérapeutique d’un tel cas incite à se poser la question du ratio bénéfice-risque d’une médication.
La performance, l’innocuité et le caractère réversible du trilostane nous conduit à choisir le VETORYL® (120 mg SID). La gestion topique des troubles dermatologiques associe des shampooings SEBLYTIC® et HUMIDERM® lors du rinçage. Les ulcérations des callosités sont prises en charge avec FORUDINE®.
Dermatologiquement, l’efficacité de la thérapie est très satisfaisante avec une repousse pilaire des zones alopéciques observées dès la troisième semaine (photo6). De même, une amélioration est constatée du squamosis et des callosités des points de pression. Le rétablissement cutané se poursuivra pour atteindre un rétablissement complet au bout de 3 mois (photo7).
Les tests de stimulation à l’ACTH réalisés durant le suivi confirment l’amélioration dermatologique. Les valeurs sont conformes aux valeurs usuelles dès la troisième semaine. La posologie minimale de trilostane nécessaire et suffisante pour le maintien de tests ACTH corrects et d’une efficacité thérapeutique est établie à 60 mg SID. Au bout de 18 mois de suivi, la chienne conservait son dynamisme, le roussissement du pelage avait disparu et tout le territoire cutané était jugé sain (photo8). A 24 mois, suite à l’arrêt par le propriétaire de la thérapie, la chienne a rechuté (photos9)…
Photo 6 : Vue d’ensemble de la lésion cutanée cervicale droite à 2 mois.
Noter la repousse pilaire
Photo 7 : Vue d’ensemble de la lésion cutanée cervicale droite à 3 mois.
L’ancien site alopécique est sain
Photo 8 : Vue d’ensemble de l’animal à 18 mois.
Noter la couleur noire de la robe et le rétablissement total du territoire cutané.
Photos 9 : Vues de l’animal à 24 mois.
Noter l’alopécie de la peau en région inguinale,
du raccourcissement et du roussissement des poils de la queue,
ainsi que le squamosis.
Discussion
L’intérêt de ce cas est de présenter un aspect clinique déroutant d’un syndrome largement connu : un tableau clinique sensiblement atypique et dominé par des symptômes rattachable à une hypothyroïdie. Les signes classiques du syndrome de Cushing sont discrets (alopécie) voire absents (PUPD).
Les cas touchant le système immunitaire sont particulièrement complexes à gérer. L’hypercorticisme est une dysendocrinie affectant majoritairement des animaux de plus de 10 ans sans prédisposition de sexe.
Dans 15% des cas, il s’agit d’un syndrome de Cushing primitivement surrénalien (représenté pour moitié par des chiens de plus de 20kg).
Dans 85% des cas, cette affection a une origine hypophysaire (« maladie de Cushing ») mais atteignant pour 75% d’entre eux des animaux de moins de 20 kg (avec une prédisposition raciale pour les caniches, ainsi que les teckels ou terriers).
Le cas de cette chienne croisée labrador de 34 kg, entre donc dans une fourchette plutôt peu fréquente d’animaux affectés par la maladie de Cushing, son format laissant plutôt présager majoritairement une origine surrénalienne. De plus, au sein des chiens atteints de maladie de Cushing, la tumeur hypophysaire est statistiquement un macroadénome dans seulement 20% des cas…
Le tableau clinique du syndrome de Cushing est varié. Cette affection nous évoque traditionnellement le vieux caniche présentant une polyuro-polydipsie, un abdomen dilaté et pendulaire et au pelage de chiot marqué d’une alopécie des flancs bilatérale et symétrique. L’atrophie cutanée, les comédons et la calcinose composent trois autres caractéristiques principales de cette affection…
Ce cas nous permet de rappeler ou repréciser la symptomatologie du syndrome de Cushing ; Ce « syndrome » est défini par un ensemble de symptômes classiques (« omniprésents ») et de plusieurs symptômes occasionnels.
La polyuro-polydipsie (dans 90% des cas), la polyphagie et la baisse d’activité sont considérés comme omniprésents, au même titre que les troubles cutanés regroupant l’alopécie, la modification de texture et de couleur du pelage, ainsi que l’atrophie cutanée, les macules, comédons, la calcinose, la phlébectasie, l’état kératoséborrhéique et les difficultés de cicatrisation. Enfin, l’obésité, la laxité ligamentaire et l’atrophie musculaire complètent cette liste de symptômes classiques. Nous remarquons l’aspect fruste et équivoque de la symptomatologie exprimée par la chienne pour laquelle une bonne observation des lésions (atrophie cutanée) nous permet d’avoir le signe d’appel le plus marquant.
Sachant que le syndrome de Cushing peut représenter une cause d’hypothyroïdie fonctionnelle, les autres signes cliniques présents dans ce cas semblent plus cohérent : le pelage court du bord caudal des cuisses, la léthargie, le roussissement du poil, la bradycardie…
Au travers de ce cas, nous attirons l’attention sur l’intérêt du test de freinage faible en première intention ayant permis d’établir le diagnostic de syndrome de Cushing d’origine hypophysaire comparativement au test de stimulation à l’ACTH habituellement réalisé en France (mais qui reste l’étalon du suivi du traitement). Ce cas permet aussi d’exploiter un dosage peu courant, palliant partiellement l’absence de scanner : le dosage des précurseurs de l’ACTH (pro-opiomélanocortine et pro-ACTH).
Un dernier point mérite une discussion: fallait-il traiter ce chien… ?
Nous sommes dans la situation rare dans laquelle le traitement du syndrome de Cushing peut parfois être discutable. Il est indéniable que, dans le cas d’un macroadénome hypophysaire, une radiothérapie représente la meilleure solution thérapeutique. A partir du moment où ce choix n’est pas accepté ou retenu, nous devons nous poser la question des conséquences d’une thérapie médicale. En effet, le trilostane est un inhibiteur de la stéroïdogénèse, ce qui signifie que par son usage, nous levons le rétrocontrôle négatif exercé sur le développement du macroadénome. Toutefois, il semblerait (comme l’indique l’échappement au freinage à dose faible à T0+8 heures) que le macroadénome ne soit pas très sensible à cet effet. En outre, l’imbibition de l’animal par les corticostéroïdes endogènes peut potentiellement être bénéfique au bien-être de l’animal pour peu que le propriétaire accepte l’aspect du pelage. Il pourrait être raisonnable de concevoir que ces corticoïdes endogènes soient responsable d’une action antinéoplasique sur le macroadénome. Leur levée contribuerait alors à favoriser le développement de la tumeur… C’est ce que l’on appelle le syndrome de Nelson qui reste pour l’heure totalement hypothétique sous trilostane et son déterminisme, quel que soit le traitement employé reste inconnu (l’implication du rétrocontrôle des corticoïdes étant séduisante mais non démontrée). Certains auteurs suspectent, sans que ce soit là encore démontré, que la levée d’un effet anti-inflammatoire des corticoïdes endogènes lors du traitement du syndrome de Cushing, puisse favoriser un œdème péritumoral et donc l’expression clinique du macroadénome…
Bibliographie
- Guaguere E., Prelaud P., Guide Pratique De Dermatologie Canine, Merial, 2006, 345-357.
- Gross T.L., Ihrke P., Walder E.J., Affolter V.K., Skin Diseases Of The Dog And Cat, 2006, 484-487.
- Bensignor E., Germain P.A., Dermatologie Du Chien Et Du Chat, Med’Com, 2005, 168-170.
- Harvey R.G., Mckeever P.J., Manuel De Dermatologie Canine Et Féline, Masson, 2000, 177-180.
- Scott D.W., Miller W.H., Griffin C.E., Small Animal Dermatology 6th Edition. Saunders, 2001, 798-815.
- Marignac G., Vade-Mecum De Dermatologie Vétérinaire, Med’Com, 1998, 112, 117-118.
- Guaguere E., Bensignor E., Thérapeutique Dermatologique Du Chien, Masson, 2002, 118-125.
- Heripret D., Syndrome De Cushing Chez Le Chien : Manifestations Biologiques Et Cliniques, I.D.F., 2003, 7-17.
Recherches Connexes
<strong>
maladie de cushing chien photo, espérance de vie, médecine interne, hypercorticisme, hyperadrénocorticisme, taux, reins, formation, polyurie, hormone, conséquence, hypophyse, chez les chiens, fonction, points noirs, glycémie, distension, corps, excès, hypertension artérielle, gauche, augmentation
</strong>