Auteurs : Arnaud MULLER & Éric GUAGUERE
Clinique vétérinaire Saint-Bernard
598 avenue de Dunkerque
59160 Lomme
Identification et motif de consultation
Foxy, une chienne Fox terrier à poil lisse de 5 ans, nous est présentée à la consultation pour une dermatose alopéciante chronique (un an environ)
Commémoratifs
Cette chienne n’a aucun antécédent pathologique, est nourrie avec une alimentation de qualité pour animal adulte (Hill’s Canine Maintenance ND) et vit dans un pavillon sans autre animal. Elle chasse régulièrement au terrier. Les traitements antiparasitaires sont correctement effectués (Drontal P ND tous les 6 mois et Frontline ND spray tous les mois).
Anamnèse
La dermatose est apparue un an auparavant avec des lésions alopéciques, discrètement squamo-croûteuses de la face accompagnées d’un prurit modéré (frottement de la face). Des shampooings antiseptiques (chlorhexidine, Pyoderm ND une fois par semaine pendant un mois), une corticothérapie brève (prednisolone, Mégasolone ND 1 mg/kg/j en 2 prises quotidiennes pendant 5 jours) et une antibiothérapie prolongée (marbofloxacine, Marbocyl ND 2 mg/kg/j en 1 prise) n’ont apporté qu’une amélioration partielle et transitoire. Aucune variation saisonnière n’est décrite et aucune contagion animale ou humaine n’est rapportée.
Examen clinique général
Cette chienne pèse 9,5 kg et présente un bon état général. La température rectale est de 38,7°C. La chienne ne présente aucune autre anomalie que les lésions cutanées.
Examen clinique dermatologique
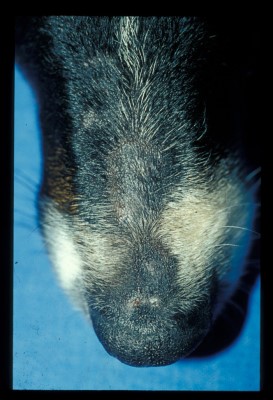
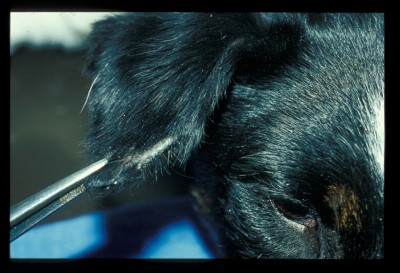
Cette chienne présente des lésions alopéciques, légèrement squameuses sur la face (chanfrein, pavillons auriculaires)
(Photos 1 à 4, ainsi que des zones alopéciques et érythémateuses sur les membres antérieurs. Le prurit est modéré.
Photo 1 : Lésions alopéciques nummulaires sur le chanfrein
Photo 2 : Lésions diffuses alopéciques et discrètement squameuses sur le chanfrein
Photo 3 : Zone alopécique sur le bord antérieur du pavillon auriculaire droit
Photo 4 : Zone alopécique sur le bord antérieur du pavillon auriculaire gauche
(présence de squames sur le pavillon)
Hypothèses diagnostiques
Le diagnostic différentiel comprend essentiellement une dermatophytie (due à Microsporum persicolor en particulier), une démodécie ou une pyodermite.
Examens complémentaires
- Les raclages cutanés ne révèlent aucun parasite.
- L’examen cytologique (calque par impression) ne met en évidence aucune multiplication bactérienne, ni aucune cellule acantholytique.
- L’examen microscopique de poils et de squames-croûtes ne montre aucun élément fongique ni aucun parasite visible. L’examen en lumière de Wood réalisé au préalable est également négatif.
- La culture fongique (ensemencement de squames-croûtes sur une gélose de Sabouraud, Pr Bourdoiseau, ENVL, résultat reçu 3 semaines après l’envoi, plusieurs repiquages ayant été nécessaires) permet de mettre en évidence la présence de colonies dont les caractéristiques suivantes permettent d’identifier un Microsporum persicolor :
- aspect macroscopique : recto de couleur blanc crème et de surface poudreuse avec un centre plus feutré, verso de couleur jaune brun
- aspect microscopique (observation après prélèvement par la technique du drapeau de Roth) : microconidies nombreuses, rondes ou ovales, organisées en acladium, macroconidies également nombreuses, fusiformes (« en cigare »), à paroi mince, de grande taille (30 à 50 m m de longueur) et possédant plus de 5 logettes. Certaines macroconidies sont pourvues d’échinulations. Enfin, des vrilles à bas large sont fréquemment observées.
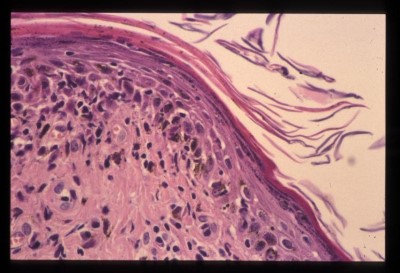
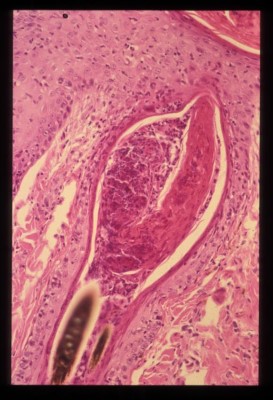
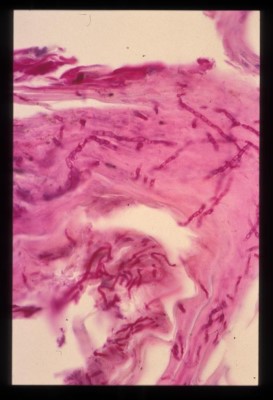
- L’ analyse histopathologique de biopsies cutanées (2 biopsies au biopsy-punch sur une lésion d’un membre et une lésion squamo-croûteuse de la face), réalisée au LAPVSO, montre une hyperkératose orthokératosique épidermique diffuse avec acanthose régulière et la présence de squames-croûtes. Le derme est inflammatoire sous forme d’une infiltration cellulaire lichénoïde et périannexielle, essentiellement composée de lymphocytes et de plasmocytes (Photo 5). Cet infiltrat est notamment présent en bande sous-épidermique et s’accompagne d’une dégénérescence hydropique de certaines cellules de la couche basale, formant ainsi une véritable dermatite lichénoïde d’interface. Des lésions de folliculite, riches en neutrophiles, sont également retrouvées (Photo 6). Une coloration à l’Acide Périodique de Schiff permet la visualisation de nombreuses hyphes mycéliennes septées colonisant la kératine de surface et la kératine péripilaire (en faveur d’une dermatophytie superficielle) (Photo 7).
Photo 5
Photo 6
Photo 7
Diagnostic
Dermatophytie à Microsporum persicolor
Traitement et suivi
- Compte tenu de la forte suspicion clinique de dermatophytie à Microsporum persicolor, le traitement antifongique est débuté à la suite de la première consultation sans attendre les résultats différés (culture fongique et analyse histopathologique). Une administration de kétoconazole (Ketofungol ND, 10 mg/kg/j par voie orale en une prise quotidienne) est prescrite pour 40 jours, associée à des shampooings hebdomadaires à la chlorhexidine (Vetriderm chlorhexidine ND) pendant un mois.
- Le contrôle à 15 jours montre une très nette amélioration des lésions cutanées avec une disparition totale de l’érythème sur les membres et des squames sur la face et les membres. Le prurit est maintenant absent. Persiste uniquement l’alopécie, même si une repousse des poils est déjà visible. L’amélioration des lésions et la réception du résultat de l’examen histopathologique nous amènent à poursuivre ce traitement à l’identique.
- Au contrôle à 30 jours, les lésions cutanées ont complètement disparu (guérison clinique). Les shampooings sont arrêtés et le kétoconazole est poursuivi 10 jours supplémentaires. Une culture fongique (prélèvement par la technique de la brosse à dent stérile) se révèle alors négative (Pr Bourdoiseau, ENVL).
- Le contrôle à 90 jours ne met en évidence aucune nouvelle lésion.
- Aucune récidive n’a été observée deux ans après la fin du traitement.
Discution
- Microsporum persicolor est un champignon zoophile (contamination par les animaux) qui constitue un résident naturel et un pathogène occasionnel des petits rongeurs sauvages comme les campagnols, hamsters, lérots, musaraignes ou mulots (mais il a aussi été isolé chez des chauve-souris, lapins ou oiseaux divers). Ces petits mammifères sont généralement asymptômatiques et représentent le réservoir principal (jusqu’à 50 % pourraient être porteurs) et la source majeure de contamination humaine et animale, essentiellement par contact direct avec leurs poils (localisation préférentielle sur les poils de la queue). Ces notions épidémiologiques prouvent l’importance de l’anamnèse lors de suspicion de dermatophytie à Microsporum persicolor, avec une nécessaire interrogation des propriétaires sur la possibilité d’un contact de l’animal avec des petits mammifères (chien chasseur notamment). C’est l’un des éléments de l’anamnèse qui nous a permis d’envisager en premier lieu une dermatophytie à Microsporum persicolor chez notre chienne. L’aspect clinique de ce cas est un autre élément fortement évocateur puisque l’atteinte de la face et des membres antérieurs est très souvent retrouvée, s’agissant des zones de contact préférentielles avec les petits mammifères (chiens pénétrant dans les terriers). Ainsi, dans l’étude de Carlotti et Bensignor, 10 chiens sur 13 présentent des lésions sur le museau, les oreilles, autour des yeux, le cou ou les membres antérieurs.
- Certaines particularités diagnostiques méritent d’être soulignées. L’examen des poils au microscope optique n’est d’aucune utilité puisque Microsporum persicolor n’envahit jamais le poil. De même, Microsporum persicolor ne produisant pas de ptéridine, responsable de la fluorescence en lumière de Wood, cet examen se révèle toujours négatif, comme dans notre cas.
Bien que la mise en évidence d’éléments fongiques par une analyse histopathologique (biopsies cutanées) soit possible dans 70 à 80 % des cas de dermatophytie, cet examen reste souvent décevant dans le cas particulier de l’atteinte par Microsporum persicolor car ce champignon est très superficiel et se trouve plus facilement éliminé lors de la réalisation des coupes histologiques. Une coloration classique à l’hématéine éosinée, ou mieux une coloration de Gomori-Grocott ou à l’acide périodique de Schiff, peut dans quelques cas révéler la présence de filaments mycéliens. Ainsi, pour cette chienne, la suspicion clinique et la découverte d’une folliculite a amené l’histopathologiste à rechercher des éléments figurés et à réaliser une coloration à l’acide périodique de Schiff, permettant d’étayer l’hypothèse de dermatophytie. Le diagnostic définitif nécessite cependant toujours une culture fongique.
La découverte d’une dermatite lichénoïde d’interface chez cette chienne mérite d’être discutée. En effet, ce pattern lésionnel était jusqu’alors évocateur de lupus cutané, d’érythème polymorphe, de lymphome cutané (infiltrat lymphocytaire), de syndrome de Vogt-Koyanagi-Harada ou de leishmaniose (infiltrat histiocytaire). Sur 8 autres cas de dermatophytie à Microsporum persicolor (Guaguère et Muller, observations personnelles), les biopsies cutanées ont toutes montré la présence d’une dermatite lichénoïde d’interface, ce qui nous amène maintenant à considérer cette dermatose comme une des causes de dermatite lichénoïde d’interface (important à considérer pour éviter des erreurs diagnostiques, notamment lorsque les symptômes cliniques peuvent évoquer un lupus cutané). Des études complémentaires sont toutefois nécessaires pour caractériser précisément cet infiltrat et pour mieux comprendre le mécanisme d’apparition de ce mode réactionnel. - La guérison de notre chienne a été obtenue très rapidement, ce qui s’explique en partie par le caractère très superficiel de la colonisation par Microsporum persicolor (pas de pénétration du poil ni des couches profondes de l’épiderme), qui est donc aisément éliminé par un traitement antifongique adapté. Dans notre expérience, un traitement de 40 à 60 jours au kétoconazole (10 mg/kg/j en une prise quotidienne) ou à la griséofulvine (20 à 60 mg/kg/j en deux prises quotidiennes) permet toujours la guérison. Nous avons choisi de ne pas utiliser d’énilconazole en traitement topique complémentaire, notamment du fait de l’absence de risque de contagiosité de la chienne vers ses propriétaires (aucune description de contamination humaine dans les cas de dermatophytie à Microsporum persicolor chez le chien). En revanche, lors d’atteinte moins importante, un traitement exclusivement topique pourrait vraisemblablement être suffisant (localisation superficielle du champignon dans l’épiderme).
Remerciements
À Frédérique Degorce-Rubiales du LAPVSO pour l’analyse histopathologique et les superbes clichés
Au Pr Georges Bourdoiseau de l’ENVL pour l’analyse de la culture fongique