Depuis plusieurs années, la prise orale de probiotiques pour aider à prévenir ou à contrôler les signes cliniques de dermatite atopique suscite l’intérêt. Plus récemment, les postbiotiques (bactéries inactivées) ont également été étudiés.
Marie CAUQUIL1, Thierry OLIVRY2
[1] Nextmune, 3 rue Pierre-Gilles de Gennes, ZA Le Causse, 81100 Castres, France
[2] Nextmune AB, Riddargatan 19, 114 57 Stockholm, Sweden
Leurs effets sur le système immunitaire pourraient être intéressants lors de DAC, maladie inflammatoire chronique de la peau qui implique un déséquilibre entre les réponses immunitaires Th1 anti-allergiques et Th2 pro-allergiques.
Dans cette étude, deux postbiotiques, Lactobacillus rhamnosus et Lactobacillus reuteri, présents dans Linkskin® comprimés ont été mis en culture avec des cellules mononuclées sanguines (PBMC) de chiens sains, afin d’évaluer leurs effets immunomodulateurs sur la sécrétion de cytokines de type Th1, Th2 et Treg.
Introduction
La dermatite atopique canine (DAC) est une maladie cutanée inflammatoire héréditaire, prurigineuse et principalement médiée par les lymphocytes T [1]. Dans les phases aiguës de la DAC, une réponse Th2 semble prédominer, alors que dans les phases chroniques, les réponses immunitaires semblent être mixtes, avec une interaction entre de multiples cytokines, y compris celles typiques des réponses immunitaires Th1 et Th17 [2-4]. Les cytokines Th2 favorisent la production d’anticorps de type immunoglobuline E (IgE) par les lymphocytes B et le recrutement de cellules inflammatoires typiquement associées aux réactions d’hypersensibilité, telles que les éosinophiles.
Probiotiques et postbiotiques, nouveaux acteurs dans la prise en charge de la DAC
Ces dernières années, la recherche sur les bienfaits des probiotiques oraux (micro-organismes vivants qui, en quantités suffisantes, améliorent la santé [6]) chez les patients atteints de dermatite atopique a gagné en intérêt. Le concept de la prise orale de probiotiques vivants chez les sujets atopiques, repose sur le dogme selon lequel, en plus de la dysbiose cutanée démontrée chez les patients atopiques humains [7,8] et canins [9-11], une dysbiose intestinale serait également observée et pourrait prédisposer au développement de la DAC à travers différents mécanismes [7,8,15,16].
Les espèces de Lactobacillus font partie des populations les plus étudiées et fréquemment retrouvées dans les probiotiques oraux.
Plus récemment, les postbiotiques (bactéries inactivées) ont suscité un nouvel intérêt et ont montré dans diverses études leurs effets bénéfiques potentiels sur la santé [21-23].
Avantages des postbiotiques
L’utilisation de postbiotiques présentent plusieurs avantages.
En effet, ils offrent une stabilité intrinsèque supérieure à celles des probiotiques qui sont difficiles à maintenir en vie. De plus, ils sont considérés comme plus sûrs que les probiotiques car ils ne conservent ni leur capacité de proliférer ni de concurrencer le microbiote local. Les postbiotiques exercent leurs effets bénéfiques par divers mécanismes, tels que l’amélioration de la fonction barrière épithéliale intestinale et la modulation des réponses immunitaires locales et systémiques [21,23]. Enfin, grâce à leurs propriétés immunomodulatrices, ils peuvent transformer une réponse Th2 en une réponse Th1 et/ou Treg [25-27].
Objectif
Dans cette étude, deux postbiotiques, Lactobacillus rhamnosus et Lactobacillus reuteri, présents dans Linkskin® comprimés ont été mis en culture avec des cellules mononuclées sanguines (PBMC) de chiens sains, afin d’évaluer leurs effets immunomodulateurs sur la sécrétion de cytokines de type Th1, Th2 et Treg.
Méthode
Les PBMC de 5 chiens sains, sans antécédant allergique, ont été prélevées et cultivées in vitro pendant 72 heures avec chacune des deux souches de Lactobacillus rhamnosus SGL01 ou de Lactobacillus reuteri SGL06, inactivées à la chaleur (tyndallisées). Une solution saline a été utilisée comme contrôle négatif (sans postbiotique).
Des surnageants ont été prélevés avant, après 12, 24, 48 et 72h à partir du début de la co-culture. Les niveaux de cytokines d’interféron-γ et d’IL-12 ont été mesurés par ELISA (Bio-Techne R&D Systems, Minneapolis, MN, USA) pour évaluer l’impact des postbiotiques sur la polarisation Th1, tandis que ceux d’IL-4 et d’IL-10 ont été sélectionnés comme biomarqueurs de la polarisation Th2 et Treg, respectivement.
Pour terminer, les indices de stimulation des niveaux de cytokines ont été calculés à partir des niveaux de cytokines obtenus après culture avec chacune des deux bactéries testées, et comparés au contrôle.
Résultats
Profil cytokinique des PBMC de chiens sains après stimulation par les postbiotiques
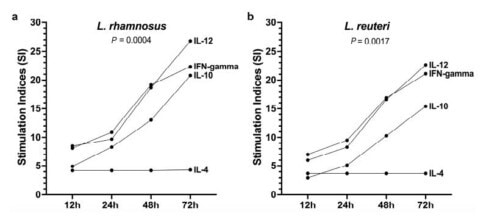
L’incubation des PBMC canines avec l’un ou l’autre des deux lactobacilles tyndallisés a entraîné des augmentations significatives (ANOVA de Friedman) des cytokines libérées dans les surnageants de culture, à partir de 12 heures après le début de la période d’incubation et tout au long des 72 heures de co-culture. Cependant, le niveau d’augmentation était variable selon les cytokines. En effet, alors que les niveaux d’IL-12 et IL-10 ont le plus augmenté, celui de l’IL-4 n’a augmenté que légèrement.
- Ainsi, la médiane des rapports IL-12/IL-4 pour les cinq chiens était de 11 et 10 pour rhamnosus et L. reuteri, respectivement, suggérant que les cytokines produites favoriseraient une réponse immunitaire de type Th1 plutôt que de type Th2.
Indice de stimulation (SI)
Les deux postbiotiques ont démontré des profils de stimulation similaires, comme le montre la figure 1 ci-dessous. L’indice de stimulation pour les deux types de bactéries a augmenté progressivement et de manière significative au fil du temps.
- Ces résultats indiquent que les Lactobacillus rhamnosus et reuteri tyndallisés, peuvent stimuler les PBMC de chiens sains pour favoriser la libération de cytokines Th1 (IL-12 et IFN-γ) et Treg (IL-10), contrairement aux niveaux de stimulation beaucoup plus faibles de la cytokine Th2 IL-4.
Figure 1 : Médianes des indices de stimulations du taux de cytokines libérées dans les PBMC de chiens sains après 12 à 72h d’incubation avec L.rhamnosus et L. reuteri tyndallisés.
Conclusion
Pour la première fois, il a été démontré que les deux postbiotiques tyndallisés L. rhamnosus et L. reuteri, contenus dans Linkskin ® comprimés, exercent des effets immunomodulateurs sur les PBMC de chiens sains in vitro. En effet, ils ont stimulé la sécrétion des cytokines Th1 IL-12 et IFN-γ ainsi que celle de la cytokine Treg IL-10. En revanche, leur effet sur la cytokine Th2 IL-4 était moins prononcé, suggérant qu’ils favoriseraient une réponse Th1 au détriment d’une réponse Th2, ce qui pourrait avoir des effets antiallergiques.
Ces résultats suggèrent que les postbiotiques testés méritent une évaluation plus approfondie de leurs avantages cliniques dans la prise en charge des poussées allergiques ou en prévention des rechutes. Pour lire l’article dans son intégralité, c’est par ICI !
Pour nous contacter : contact-france@nextmune.com
Références
[1] Eisenschenk, M.C.; Hensel, P.; Saridomichelakis, M.N.; Tamamoto-Mochizuki, C.; Pucheu-Haston, C.M.; Santoro, D. Introduction to the ICADA 2023 Canine Atopic Dermatitis Pathogenesis Review Articles and Updated Definition. Vet. Dermatol. 2024, 35, 3–4. [CrossRef]
[2] Pucheu-Haston, C.M.; Bizikova, P.; Marsella, R.; Santoro, D.; Nuttall, T.; Eisenschenk, M.N.C. Review: Lymphocytes, Cytokines, Chemokines and the T-helper 1–T-helper 2 Balance in Canine Atopic Dermatitis. Vet. Dermatol. 2015, 26, 124-e32. [CrossRef]
[3]. Tamamoto-Mochizuki, C.; Santoro, D.; Saridomikelakis, M.N.; Eisenschenk, M.N.C.; Hensel, P.; Pucheu-Haston, C.; International Committee on Allergic Diseases of Animals (ICADA). Update on the Role of Cytokines and Chemokines in Canine Atopic Dermatitis. Vet. Dermatol. 2024, 35, 25–39. [CrossRef]
[4]. Olivry, T.; Mayhew, D.; Paps, J.S.; Linder, K.E.; Peredo, C.; Rajpal, D.; Hofland, H.; Cote-Sierra, J. Early Activation of Th2/Th22 Inflammatory and Pruritogenic Pathways in Acute Canine Atopic Dermatitis Skin Lesions. J. Investig. Dermatol. 2016, 136, 1961–1969. [CrossRef]
[6]. Hill, C.; Guarner, F.; Reid, G.; Gibson, G.R.; Merenstein, D.J.; Pot, B.; Morelli, L.; Canani, R.B.; Flint, H.J.; Salminen, S.; et al. Expert Consensus Document: The International Scientific Association for Probiotics and Prebiotics Consensus Statement on the Scope and Appropriate Use of the Term Probiotic. Nat. Rev. Gastroenterol. Hepatol. 2014, 11, 506–514. [CrossRef]
[7]. Lee, S.-Y.; Lee, E.; Park, Y.M.; Hong, S.-J. Microbiome in the Gut-Skin Axis in Atopic Dermatitis. Allergy Asthma Immunol. Res. 2018, 10, 354–362. [CrossRef]
[8]. Alam, M.J.; Xie, L.; Yap, Y.-A.; Marques, F.Z.; Robert, R. Manipulating Microbiota to Treat Atopic Dermatitis: Functions and Therapies. Pathogens 2022, 11, 642. [CrossRef]
[9]. Thomsen, M.; Künstner, A.; Wohlers, I.; Olbrich, M.; Lenfers, T.; Osumi, T.; Shimazaki, Y.; Nishifuji, K.; Ibrahim, S.M.; Watson, A.; et al. A Comprehensive Analysis of Gut and Skin Microbiota in Canine Atopic Dermatitis in Shiba Inu Dogs. Microbiome 2023, 11, 232. [CrossRef]
[10]. Pierezan, F.; Olivry, T.; Paps, J.S.; Lawhon, S.D.; Wu, J.; Steiner, J.M.; Suchodolski, J.S.; Rodrigues Hoffmann, A. The Skin Microbiome in Allergen-induced Canine Atopic Dermatitis. Vet. Dermatol. 2016, 27, 332-e82. [CrossRef]
[11]. Bradley, C.W.; Morris, D.O.; Rankin, S.C.; Cain, C.L.; Misic, A.M.; Houser, T.; Mauldin, E.A.; Grice, E.A. Longitudinal Evaluation of the Skin Microbiome and Association with Microenvironment and Treatment in Canine Atopic Dermatitis. J. Investig. Dermatol. 2016, 136, 1182–1190. [CrossRef]
[15]. Wrze´sniewska, M.; Wołoszczak, J.; ´Swirkosz, G.; Szyller, H.; Gomułka, K. The Role of the Microbiota in the Pathogenesis and Treatment of Atopic Dermatitis—A Literature Review. Int. J. Mol. Sci. 2024, 25, 6539. [CrossRef]
[16]. Salem, I.; Ramser, A.; Isham, N.; Ghannoum, M.A. The Gut Microbiome as a Major Regulator of the Gut-Skin Axis. Front. Microbiol. 2018, 9, 1459. [CrossRef]
[21]. Fiore, W.; Arioli, S.; Guglielmetti, S. The Neglected Microbial Components of Commercial Probiotic Formulations. Microorganisms 2020, 8, 1177. [CrossRef]
[22]. Piqué, N.; Berlanga, M.; Miñana-Galbis, D. Health Benefits of Heat-Killed (Tyndallized) Probiotics: An Overview. Int. J. Mol. Sci. IJMS 2019, 20, 2534. [CrossRef]
[23]. Salminen, S.; Collado, M.C.; Endo, A.; Hill, C.; Lebeer, S.; Quigley, E.M.M.; Sanders, M.E.; Shamir, R.; Swann, J.R.; Szajewska, H.; et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) Consensus Statement on the Definition and Scope of Postbiotics. Nat. Rev. Gastroenterol. Hepatol. 2021, 18, 649–667. [CrossRef]
[25]. Taverniti, V.; Guglielmetti, S. The Immunomodulatory Properties of Probiotic Microorganisms beyond Their Viability (Ghost Probiotics: Proposal of Paraprobiotic Concept). Genes Nutr. 2011, 6, 261–274. [CrossRef]
[26]. Kim, Y.-K.; Cho, M.; Kang, D.-J. Anti-Inflammatory Response of New Postbiotics in TNF-α/IFN-γ-Induced Atopic Dermatitis-like HaCaT Keratinocytes. Curr. Issues Mol. Biol. 2024, 46, 6100–6111. [CrossRef]
[27]. Hua, M.-C.; Lin, T.-Y.; Lai, M.-W.; Kong, M.-S.; Chang, H.-J.; Chen, C.-C. Probiotic Bio-Three Induces Th1 and Anti-Inflammatory Effects in PBMC and Dendritic Cells. World J. Gastroenterol. 2010, 16, 3529–3540. [CrossRef]